Основные оксиды и кислоты являются важными компонентами химической реакции, которую называют нейтрализацией. Взаимодействие этих веществ базируется на основных принципах химии и имеет свои особенности.
Основные оксиды – это химические соединения, обладающие щелочными свойствами. Они образуются при соединении различных химических элементов с кислородом. Примеры основных оксидов включают оксид натрия, оксид калия и оксид кальция. Эти соединения часто встречаются в природе и широко используются в различных сферах промышленности.
Кислоты, напротив, являются веществами с кислотными свойствами. Они могут быть органическими (например, уксусная кислота) или неорганическими (например, серная кислота). Кислоты играют важную роль в химических реакциях и широко применяются в различных отраслях промышленности.
Взаимодействие основных оксидов с кислотами основано на принципе нейтрализации. В результате реакции основного оксида с кислотой образуется соль и вода. Например, взаимодействие оксида натрия с соляной кислотой приводит к образованию хлорида натрия и воды:
Na2O + 2HCl → 2NaCl + H2O
При этом происходит передача протона от кислоты к основному оксиду, что приводит к образованию соли и воды. Реакции взаимодействия основных оксидов с кислотами происходят с выделением тепла, что является одной из их особых особенностей.
Взаимодействие основных оксидов с кислотами имеет значительное практическое применение. Например, при нейтрализации серной кислоты оксидом кальция получается сернистый газ, который широко используется, например, в пищевой и фармацевтической промышленности. Также реакции нейтрализации основных оксидов с кислотами применяются при очистке отходов и водоочистке.
Оксиды и кислоты: как они действуют друг на друга?
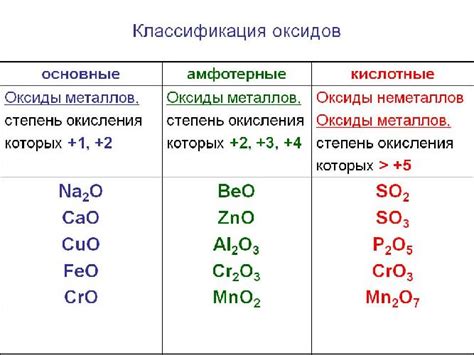
Как правило, оксиды представляют собой соединения металлов с кислородом, и они обладают щелочными свойствами. Кислоты, напротив, являются соединениями, в которых водород связан с кислородом или другими неметаллами. Они обладают кислотными свойствами.
Во время реакции оксиды и кислоты происходит взаимный обмен ионами. Кислота отдаёт ион водорода (H+) оксиду, который, в свою очередь, отдаёт свои ионы оксидного радикала (O2-). При этом образуется соль, и вода может образовываться, если изначально была в кислоте или оксиде. Реакции такого типа называют нейтрализационными.
Важно отметить, что реакция между оксидами и кислотами зависит от их соотношения и химической формулы. Различные оксиды и кислоты могут образовывать разные соли и показывать различную степень реактивности. Кроме того, процесс образования соли может быть экзотермическим или эндотермическим, то есть сопровождаться выделением или поглощением тепла.
Таким образом, взаимодействие оксидов с кислотами является важным аспектом химических реакций. Оно происходит по принципу образования соли и воды, где ионы кислоты и оксида обмениваются между собой. Эти реакции имеют свои особенности в зависимости от соотношения и химической формулы соединений, и могут сопровождаться выделением или поглощением тепла.
Взаимодействие основных оксидов с кислотами: основные принципы

Основные оксиды могут реагировать с кислотами и образовывать соли и воду. Для процесса реакции необходимо, чтобы кислота обладала свойствами амфотерного вещества или диссоциировала в воде, а основный оксид обладал высокой степенью основности. Именно эти факторы определяют возможность взаимодействия между ними.
Основные принципы взаимодействия основных оксидов с кислотами заключаются в следующем:
| Основные принципы |
|---|
| 1. Взаимодействие основных оксидов с кислотами происходит по принципу нейтрализации, при которой образуются соли и вода. |
| 2. Взаимодействие зависит от свойств кислоты и основного оксида. Чем сильнее основность основного оксида и кислотность кислоты, тем интенсивнее протекает реакция. |
| 3. При взаимодействии основных оксидов с кислотами происходит образование солей, которые представляют собой ионные соединения металла и аниона кислоты. |
| 4. Вода, образующаяся в результате реакции, является нейтральной и не оказывает влияния на степень основности или кислотности взаимодействующих веществ. |
Таким образом, взаимодействие основных оксидов с кислотами основывается на принципах нейтрализации, сильной основности и кислотности веществ, а также образовании солей и воды. Эти принципы играют важную роль в химии и имеют множество практических применений в различных отраслях промышленности и науки.
Особенности взаимодействия кислот с оксидами основных элементов

Основные аспекты, которые следует учитывать при взаимодействии кислот с оксидами основных элементов:
- Тип кислоты и оксида: разные кислоты имеют разные свойства и способность взаимодействовать с оксидами. Например, сильные минеральные кислоты, такие как серная и соляная, могут реагировать с большинством оксидов, в то время как более слабые органические кислоты имеют ограниченную реактивность.
- Соотношение между кислотой и оксидом: для успешного взаимодействия необходимо соблюдать правильное соотношение между кислотой и оксидом. Обычно это соотношение определяется стехиометрическими коэффициентами в уравнении реакции.
- Реакционные условия: реакция между кислотой и оксидом может протекать при разных условиях, таких как температура, давление, наличие катализаторов и др. Некоторые реакции могут быть эндотермическими, т.е. требующими поступления тепла, в то время как другие - экзотермическими, т.е. выделяющими тепло.
- Образование солей и воды: основной результат взаимодействия кислоты с оксидом - образование соли и воды. Физико-химические свойства получаемой соли зависят от ее состава и структуры.
Понимание особенностей взаимодействия кислот с оксидами основных элементов является важной предпосылкой для успешной промышленной и лабораторной химии, а также для понимания многих естественных процессов, происходящих в природе.
Примеры реакций и реакционных способностей основных оксидов

Основные оксиды представляют собой химические соединения, которые реагируют с кислотами, образуя соли и воду. Данная реакция происходит в соответствии с общим химическим уравнением:
Оксид + кислота → соль + вода
Ниже представлены примеры реакций основных оксидов с известными кислотами:
- Оксид кальция (CaO) + соляная кислота (HCI) → хлорид кальция (CaCl2) + вода (H2O)
- Оксид натрия (Na2O) + серная кислота (H2SO4) → сульфат натрия (Na2SO4) + вода (H2O)
- Оксид калия (K2O) + азотная кислота (HNO3) → нитрат калия (KNO3) + вода (H2O)
Таким образом, основные оксиды обладают способностью образовывать соли и воду при взаимодействии с кислотами. Это свойство основных оксидов имеет большое значение в химической промышленности и в природных процессах.
Роль взаимодействия оксидов с кислотами в природных и технических процессах

В природе такие реакции являются неотъемлемой частью геологических процессов. Например, вулканические извержения могут приводить к взаимодействию основных оксидов с кислотными газами, что в результате приводит к образованию сульфатов, нитратов и других солей. Эти соли могут выпадать в виде осадков и оказывать значительное влияние на почву, воду и окружающую среду.
В технических процессах взаимодействие оксидов с кислотами также имеет большое значение. Например, при производстве стали оксид железа (Fe2O3) взаимодействует с кислородом (O2) в реакторе Бессемера, что позволяет получить высококачественную сталь. Эти реакции также могут использоваться для конверсии полезных ископаемых, таких как руды или сырой нефти, в более ценные продукты.
Кроме того, взаимодействие оксидов с кислотами играет важную роль в химической промышленности. Например, реакция между оксидом алюминия (Al2O3) и кислотой серной (H2SO4) позволяет получать алюминийсодержащие соли, которые находят широкое применение в производстве автомобильных деталей, строительных материалов и других товаров.
В целом, взаимодействие оксидов с кислотами является важным химическим процессом, который находит применение в различных сферах деятельности человека и играет значительную роль в формировании и преобразовании веществ в природе.