Ученые давно обратили внимание на то, что давление может оказывать значительное влияние на характеристики различных физических и химических процессов. В частности, давление может существенно изменять скорость химической реакции. Почему это происходит и какие связи существуют между давлением и скоростью реакции?
Одним из ключевых факторов, влияющих на химическую реакцию, является концентрация реагирующих веществ. Чем выше концентрация, тем больше частиц в единице объема и тем больше вероятность их столкновения, что способствует увеличению скорости реакции. Давление связано с концентрацией веществ, так как при увеличении давления увеличивается плотность газовых компонентов и, следовательно, их концентрация. Поэтому увеличение давления может привести к увеличению скорости реакции.
Однако давление оказывает важное влияние не только на концентрацию, но и на кинетические свойства молекул. Основными параметрами, определяющими движение молекул, являются температура и давление. Увеличение давления увеличивает силу столкновений молекул друг с другом, что способствует активации реакционных центров и увеличению скорости реакции. Более того, изменение давления может оказывать влияние на молекулярную структуру реагирующих веществ, что также может приводить к изменению скорости реакции.
Одним из примеров, иллюстрирующих влияние давления на скорость реакции, является реакция газового взрыва. При увеличении давления взрыва увеличивается концентрация газовых компонентов, а также уменьшается объем, в котором происходит реакция. Это приводит к увеличению частоты столкновений молекул и увеличению силы столкновений. В результате скорость реакции газового взрыва значительно повышается.
Влияние давления на скорость реакции
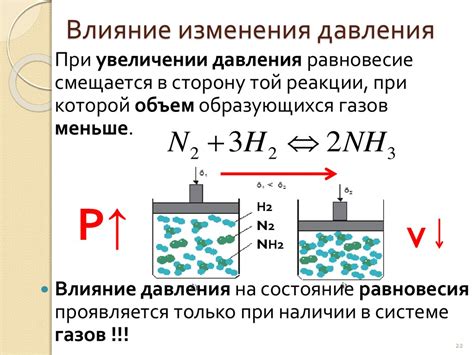
Для понимания влияния давления на скорость реакции необходимо продемонстрировать зависимость скорости химической реакции от изменения давления. Для этого проводят эксперименты с различными условиями давления, фиксируют результаты и проводят анализ полученных данных.
Исследования показывают, что с увеличением давления реакция может протекать быстрее. Это связано с тем, что увеличение давления приводит к увеличению концентрации и частоты столкновений молекул реагирующих веществ. Более высокая концентрация веществ усиливает вероятность столкновения молекул, что, в свою очередь, приводит к увеличению количества проходящих реакций за единицу времени.
| Величина давления | Скорость реакции |
|---|---|
| Высокое давление | Увеличена |
| Низкое давление | Снижена |
| Равновесное давление | Стабилизирована |
Однако, следует отметить, что влияние давления на скорость реакции не всегда существенно. Некоторые реакции практически не реагируют на изменение давления, и их скорость остается почти неизменной.
Также стоит отметить, что влияние давления на скорость реакции зависит от характера реагирующих веществ и исходных условий. Например, реакции с механизмом реакции, включающим стадию разрыва или образования химических связей, могут быть почти нечувствительны к давлению.
В целом, влияние давления на скорость химических реакций зависит от ряда факторов, таких как концентрация и свойства реагирующих веществ, катализаторы, температура и давление. Изучение этих факторов и их влияния на скорость реакции является одной из важных задач химической кинетики.
Связь между давлением и скоростью реакции
Во-первых, изменение давления влечет за собой изменение плотности газовых компонентов реакционной смеси. Увеличение давления приводит к увеличению количества молекул в единице объема, что увеличивает вероятность их столкновений. Плотность газов определяет частоту столкновений между молекулами, что в свою очередь влияет на скорость реакции.
Во-вторых, повышение давления может изменить скорость реакции путем изменения концентрации реагентов. Реакционная способность зависит от концентрации реагентов, и повышение давления может привести к увеличению числа молекул реагентов в единице объема. Это, в свою очередь, увеличивает частоту столкновений и, следовательно, скорость реакции.
Кроме того, изменение давления может влиять на равновесие между прямой и обратной реакцией. Если реакция является обратимой, изменение давления может повлиять на положение равновесия. Увеличение давления приводит к уменьшению объема газа, что способствует смещению равновесия в сторону образования меньшего количества молекул газа. Это может привести к изменению скорости протекания реакции и ее итоговому составу.
Таким образом, связь между давлением и скоростью реакции является сложной и многофакторной. Изменение давления может влиять на плотность газовых компонентов, концентрацию реагентов и равновесие между прямой и обратной реакцией. Понимание этой связи позволяет более точно контролировать кинетические и равновесные свойства химических реакций.
Параметры, которые оказывают влияние на реакцию

Скорость реакции зависит от ряда параметров, в том числе от давления, которое оказывает значительное влияние на процесс химической реакции. Повышение давления может привести к увеличению скорости реакции в некоторых случаях.
Одной из важных связей между давлением и скоростью реакции является зависимость последней от числа столкновений молекул реагентов. При повышении давления на реагенты накладывается большая сила, что увеличивает интенсивность и частоту их столкновений. В результате, вероятность эффективной столкновительной конфигурации молекул и образования активированного комплекса реагентов также увеличивается, что приводит к ускорению реакции.
Однако, есть реакции, в которых повышение давления не приводит к увеличению скорости реакции. Это происходит из-за того, что в данных реакциях величины коэффициентов структуры активированного комплекса и концентраций реагентов оказывают доминирующее влияние на скорость реакции. В случае, когда достигнуто определенное насыщение концентрации реагентов, дальнейшее увеличение давления не приводит к дальнейшему увеличению скорости реакции.
Кроме того, на скорость реакции могут оказывать влияние и другие физические параметры, такие как температура и концентрация реагентов. Взаимодействие этих параметров может быть сложным и требует детального исследования для каждого отдельного случая.
Таким образом, давление является одним из физических параметров, которые могут оказывать влияние на скорость химической реакции. Однако, для полного понимания влияния давления необходимо учитывать также другие факторы, такие как концентрация и температура, а также специфику конкретной реакции.
Взаимосвязь между давлением и температурой реакции
Когда реакция происходит в закрытой системе, изменение давления может вызвать изменение температуры реакции и наоборот. Это связано с тем, что давление и температура в химической системе связаны через уравнение состояния идеального газа.
Увеличение давления в закрытой системе приведет к уменьшению объема, что в свою очередь может вызвать повышение температуры реакции. Это объясняется тем, что с уменьшением объема в системе увеличивается плотность молекул, что приводит к более частым и энергичным столкновениям. Более энергичные столкновения, в свою очередь, приводят к повышению энергии активации и увеличению скорости реакции.
Наоборот, снижение давления может привести к увеличению объема и, как следствие, снижению температуры реакции. Увеличение объема приводит к увеличению расстояний между молекулами, что затрудняет их столкновения и понижает вероятность эффективных столкновений. Это может вызвать снижение энергии активации и снижение скорости реакции.
Таким образом, взаимосвязь между давлением и температурой реакции позволяет управлять скоростью химических процессов. В практических приложениях эту связь можно использовать для регулирования скорости реакции и оптимизации химических процессов.
Эффект давления на равновесие реакции

По принципу Ле-Шателье, изменение давления в системе может сместить равновесие реакции в ту или иную сторону. Если реакция сопровождается изменением объема газа, то изменение давления может значительно влиять на равновесие.
В случае реакции, в которой участвуют газы, увеличение давления может склонить равновесие к реагентам, а уменьшение давления - к продуктам. Это объясняется простым физическим фактом: при увеличении давления объем газа сокращается, что увеличивает концентрацию реагентов и смещает равновесие в сторону обратной реакции. В случае уменьшения давления, объем газа увеличивается, и концентрация продуктов становится выше, что способствует прямой реакции.
Однако следует отметить, что изменение давления может оказывать только косвенное влияние на равновесие реакции, не влияя на значение константы равновесия. Поэтому изменение давления может изменить состояние равновесия, но не изменить самих равновесных концентраций в системе.
Оценить влияние давления на равновесие реакции можно с помощью газового закона Авогадро, который позволяет связать объем газа с его количеством в молях. Таким образом, изменение объема газовой смеси при изменении давления может привести к изменению количества вещества в системе и, соответственно, к изменению равновесных концентраций.
В заключении можно сказать, что давление играет важную роль в определении равновесия химической реакции, однако его воздействие на равновесную константу незначительно. Изменение давления может смещать равновесие в определенном направлении, но не влияет на само равновесное значение.
Давление и концентрация реактивов

Повышение концентрации реактивов может ускорить химическую реакцию, поскольку более высока концентрация означает более частые и успешные столкновения между реактивными молекулами. Это может способствовать эффективной передаче энергии и образованию новых химических связей.
С другой стороны, изменение давления может иметь различное влияние на скорость реакции в зависимости от типа реакционной системы. В газовой фазе, повышение давления приводит к увеличению концентрации газовых молекул, что в свою очередь может привести к увеличению вероятности их столкновений и, следовательно, увеличению скорости реакции.
Однако в растворах или реакционных смесях с жидкими или твердыми реактивами, изменение давления обычно не оказывает существенного влияния на скорость химической реакции. Это связано с тем, что в растворах концентрация вещества определяется его растворимостью, а в реакционных смесях с жидкими или твердыми веществами, концентрацию реагирующих частиц ограничивает их концентрация в смеси.
Таким образом, давление и концентрация реактивов имеют важное значение для определения скорости химической реакции, но их влияние может отличаться в зависимости от типа реакционной системы.
Давление и физические свойства реакционной системы
Давление играет важную роль в химических реакциях, так как оно может влиять на скорость реакции и приводить к изменению физических свойств реакционной системы. В данном разделе мы рассмотрим, как давление воздействует на реакцию и какие изменения происходят в системе при изменении давления.
Изменение давления оказывает влияние на скорость реакции путем изменения концентрации реагентов. При повышении давления молекулы газов становятся ближе друг к другу, что приводит к увеличению вероятности их столкновений. Это приводит к увеличению частоты реакций и, следовательно, увеличению скорости реакции.
Однако увеличение давления также может приводить к изменению физических свойств реакционной системы. Например, при увеличении давления насыщающиеся газы могут растворяться лучше и быстрее, что может повысить скорость растворения реагентов. Также, при повышенном давлении может измениться фазовое состояние реагентов, например, переход газа в жидкость или жидкости в твердое состояние.
Таблица ниже представляет некоторые примеры изменения физических свойств реакционной системы при изменении давления.
| Изменение давления | Возможные изменения физических свойств |
|---|---|
| Повышение | Увеличение растворимости газа, изменение фазового состояния |
| Понижение | Уменьшение растворимости газа, изменение фазового состояния |
Как видно из таблицы, изменение давления может привести к значительным изменениям физических свойств реакционной системы. Это важно учитывать при проведении и изучении химических реакций, так как это может повлиять на ход и результаты эксперимента.
Индустриальное применение регулирования давления для управления реакциями
Одним из примеров индустриального применения регулирования давления является производство аммиака. Процесс производства аммиака осуществляется путем реакции между азотом и водородом в присутствии катализатора. В данном процессе регулирование давления является критическим, поскольку оно влияет на скорость реакции и выход продукта.
Управление давлением в процессе производства аммиака осуществляется путем подачи определенного количества газов в реактор и регулирования давления внутри него. Повышение давления увеличивает концентрацию реагентов и увеличивает скорость реакции. Однако при слишком высоком давлении возможны нежелательные побочные реакции.
В других промышленных процессах, таких как производство пластмасс, управление давлением также играет важную роль. Поддержание определенного давления в реакционной камере помогает контролировать скорость полимеризации и фазовое равновесие. Это позволяет получить продукты с желаемыми свойствами и избежать возможных проблем, таких как образование дефектов или изменение цвета.
Регулирование давления также неразрывно связано с другими физическими параметрами, такими как температура и концентрация реагентов. Вместе с ними оно позволяет оптимизировать условия реакции и достичь желаемых результатов в промышленных процессах.
Таким образом, индустриальное применение регулирования давления для управления реакциями является важным аспектом производства в различных отраслях. Правильное управление давлением позволяет достичь оптимальных условий реакции, обеспечивая эффективность, безопасность и качество продукции.