Молекулы, содержащие электроноакцепторные заместители, играют важную роль в органической химии. Эти заместители способны принимать лишние электроны и изменять электронное распределение в молекуле. Такой электроноакцепторный эффект может значительно влиять на кислотность молекулы, делая ее более или менее кислотной в зависимости от конкретного заместителя. Такое влияние может происходить через изменение электронного заряда на атомах в молекуле или через образование новых химических связей.
Электроноакцепторные заместители могут быть разного вида. Они могут быть электроноотрицательными атомами, такими как кислород или азот, или группами атомов, такими как цианогруппа. Эти заместители обладают свободными электронными парами, которые способны принять электроны от окружающих атомов. Через этот эффект они изменяют электронное распределение в молекуле, что в свою очередь может изменить кислотность молекулы. Например, карбоксильные группы с электроноакцепторным заместителем могут стать более кислотными, поскольку заместитель привлекает электроны к себе, делая карбоксильную группу более электрондефицитной.
Изменение кислотности молекулы может иметь важные последствия с точки зрения ее химической реактивности и возможности взаимодействия с другими молекулами. Например, если молекула становится более кислотной, она может лучше взаимодействовать с основаниями, что может быть полезным в некоторых химических реакциях. С другой стороны, если молекула становится менее кислотной, она может быть менее реактивной и иметь меньше возможностей для взаимодействия с другими молекулами. Поэтому изучение электроноакцепторных заместителей и их влияния на кислотность молекулы является важной задачей в органической химии и имеет практическое значение для различных областей науки и технологии.
Влияние электроноакцепторных заместителей
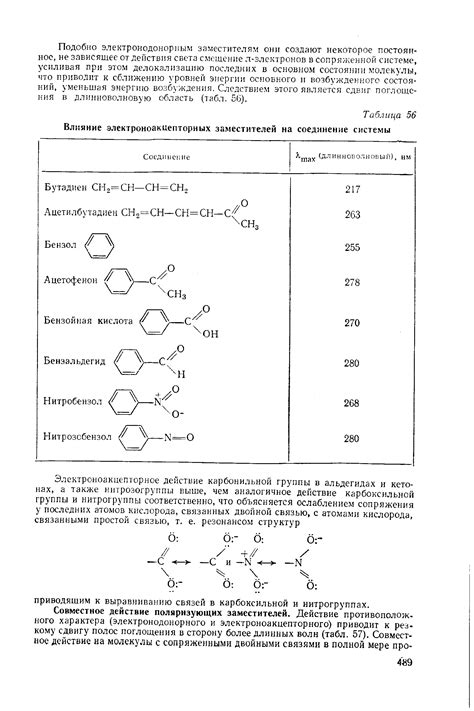
Этот процесс может оказать значительное влияние на кислотность молекулы. При присутствии электроноакцепторных заместителей в молекуле, электроны могут быть отобраны от донорного атома и перенесены на электроноакцепторный атом. Это приведет к увеличению отрицательного заряда на электроноакцепторе и снижению заряда на доноре. Поскольку кислотность молекулы обратно пропорциональна заряду донорного атома, увеличение отрицательного заряда на электроноакцепторе приведет к повышению кислотности молекулы.
Электроноакцепторные заместители могут быть представлены различными атомами или группами атомов. Некоторые из них включают нитрогруппы, галогены, карбонильные группы и оксигруппы. Исследования показали, что разные заместители могут оказывать различное влияние на кислотность молекулы в зависимости от их электроноакцепторных свойств.
Таким образом, понимание влияния электроноакцепторных заместителей на кислотность молекулы является важной задачей в органической химии. Изучение этого вопроса может привести к разработке новых соединений с оптимальными свойствами и применению в различных областях, включая фармацевтику, материаловедение и катализ.
Молекулы и их кислотность
Электроноакцепторные заместители – это атомы или группы атомов, которые принимают электроны от другой молекулы или иона, увеличивая свою электронную плотность. Влияние этих заместителей на кислотность молекулы может быть как положительным, так и отрицательным. Оно зависит от различных факторов, включая электрохимические свойства заместителей и их расположение в молекуле.
Если электроноакцепторный заместитель способен удерживать электроны, его присутствие в молекуле может увеличить её кислотность. Это происходит за счёт сдвига равновесия реакции разложения молекулы в сторону образования ионов гидрида H-. Примерами таких заместителей могут быть атомы хлора, фтора, группы NO2 (нитро), CN (циан), сульфогруппы и другие.
Однако, некоторые электроноакцепторные заместители могут также демпфировать электронную плотность в молекуле и уменьшать её кислотность. В этом случае, электроноакцепторный заместитель может ингибировать образование ионов гидрида H-, создавая электронное дефицитное состояние. Примерами таких заместителей могут быть атомы гидрогена, группы -CF3 (трифторометил), -SO3H (сульфоновая кислота) и другие.
В итоге, понимание влияния различных электроноакцепторных заместителей на кислотность молекулы является важным аспектом в органической и неорганической химии. Комбинация различных электроноакцепторных заместителей может приводить к уникальным физико-химическим свойствам молекулы, открывая новые возможности в синтезе и применении органических соединений в различных областях науки и технологии.
Электроноакцепторные заместители и их функция

Функция электроноакцепторных заместителей заключается в изменении электронной плотности главной цепи молекулы и ее кислотно-основных свойств. Они могут принимать пару электронов от других молекул, образуя новую связь, либо принимать одиночный электрон, образуя радикаль. Таким образом, электроноакцепторные заместители могут изменять активность и реакционную способность органических молекул.
Важной особенностью электроноакцепторных заместителей является их электрофильная природа. Они обладают свободными электронными парами или сопряженными пи-системами, привлекающими электроны. Это позволяет им принимать электроны от атомов или групп с электронодонорными свойствами, такими как амино, окси или гидроксильные группы.
Таблица ниже представляет некоторые из наиболее распространенных электроноакцепторных заместителей:
| Электроноакцепторные заместители | Примеры |
|---|---|
| Нитро | NO2 |
| Карбоксильная группа | C(O)OH |
| Цианогруппа | CN |
| Кетогруппа | C=O |
| Эстр | C(O)OR |
Электроноакцепторные заместители могут значительно влиять на кислотность молекулы, особенно если они расположены рядом с кислотно-акцепторным центром. Они способны изменять электронную плотность в окрестности кислотного центра и, таким образом, влиять на степень депротонирования или протонирования молекулы.
Исследование электроноакцепторных заместителей открывает новые возможности для контроля кислотно-основных свойств органических молекул и создания новых функциональных материалов с уникальными свойствами.
Механизмы влияния заместителей на кислотность

Изменение кислотности молекулы под влиянием электроноакцепторных заместителей происходит благодаря изменению электронных свойств молекулярной системы. Этот процесс может быть объяснен несколькими механизмами.
- Изменение полярности связей: Электроноакцепторный заместитель повышает полярность связей в молекуле, что приводит к увеличению электронной плотности на электроотбивающем группировке и уменьшению на электроакцептирующей.
- Индуктивный эффект: Введение электроноакцепторного заместителя в молекулу приводит к смещению электронной плотности вдоль связи, что может приводить к изменению кислотности гидрофильного центра.
- Сопоставление мезомерии: Появление электроноакцепторного заместителя приводит к возможности образования мезомерного состояния, что влияет на мезомерное сопоставление электронных структур молекулы и, следовательно, на ее кислотность.
- Процессы образования комплексов: Заместители могут вступать в образование комплексов с другими молекулами, что может менять активность кислотного центра. Этот процесс может замедлять или ускорять ионизацию и изменять химическую реакцию.
- Соляторные эффекты: Введение электроноакцепторных заместителей может привести к образованию солевого комплекса и, как следствие, изменить кислотно-основное равновесие системы.
Таким образом, электроноакцепторные заместители имеют разнообразные эффекты на кислотность молекулы, которые определяются их структурой и электронными свойствами. Понимание этих механизмов взаимодействия позволяет прогнозировать и контролировать кислотно-основные свойства молекулы.
Примеры электроноакцепторных заместителей
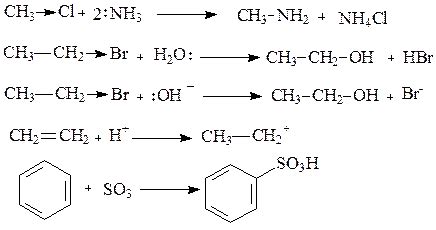
- Карбоксильная группа (-COOH) - эта группа является одним из наиболее распространенных электроноакцепторных заместителей. Она может принять электроны от других атомов или групп и образовать карбоксилат-ион, что может привести к изменению кислотности молекулы.
- Нитрогруппа (-NO2) - эта группа содержит атомы азота, которые могут принимать электроны от других атомов или групп. Нитрогруппа может создавать положительный электронный заряд и изменять кислотность молекулы.
- Сульфоновая группа (-SO3H) - эта группа содержит атомы серы, которые могут принимать электроны от других атомов или групп. Сульфоновая группа может образовывать сульфонат-ион, что может влиять на кислотность молекулы.
- Галогениды (фтор, хлор, бром, йод) - эти атомы могут принимать электроны от других атомов или групп. Галогениды могут изменять электронную структуру молекулы и влиять на ее кислотность.
Это лишь некоторые примеры электроноакцепторных заместителей, которые могут влиять на кислотность молекулы. Важно учитывать их влияние при изучении данного вопроса и проведении соответствующих исследований.
Перспективы исследований в области электроноакцепторных заместителей
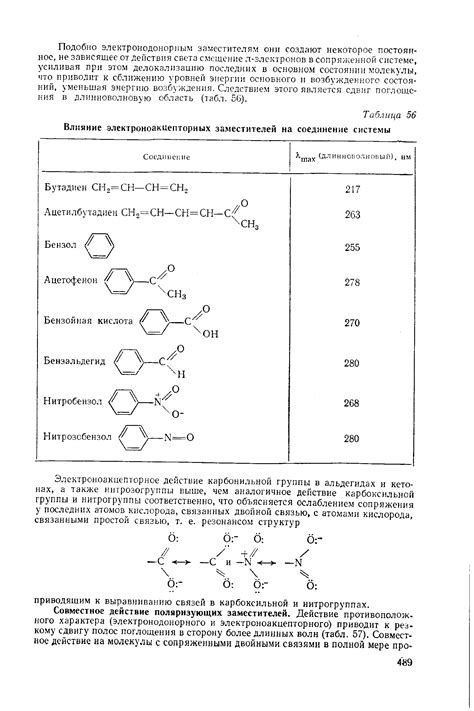
В последние годы исследования в области электроноакцепторных заместителей получили большое внимание научного сообщества. Это объясняется их способностью влиять на кислотность молекулы и, следовательно, на ее химические свойства.
Одной из главных перспектив исследований является разработка новых электроноакцепторных заместителей, которые будут обладать более высокой активностью и селективностью. Это позволит расширить спектр их применения в различных областях химии, включая фармацевтику, материаловедение и катализ.
Кроме того, дальнейшие исследования должны быть направлены на изучение механизмов взаимодействия электроноакцепторных заместителей с молекулами. Это поможет раскрыть глубинные закономерности и строение акцепторно-донорных комплексов, а также позволит улучшить предсказуемость их свойств.
Важным аспектом является также исследование влияния электроноакцепторных заместителей на кислотность молекулы в различных средах. Это поможет лучше понять взаимодействия в реальных условиях и найти возможности для оптимизации их использования.
В целом, исследования в области электроноакцепторных заместителей представляют большой интерес как для фундаментальной науки, так и для промышленности. Успех в этой области открывает широкие перспективы для создания новых и более эффективных химических соединений и материалов, что может привести к существенным прорывам в различных отраслях промышленности и науки.