Давление - один из важнейших факторов, влияющих на скорость химических реакций. Повышение давления приводит к ускорению реакции, а снижение давления, наоборот, замедляет ее. Этот эффект объясняется изменением концентрации реагентов и частоты столкновений частиц, вызванных изменением объема системы.
Повышение давления увеличивает концентрацию реагирующих веществ, так как реагенты сжимаются и занимают меньшее пространство. Это способствует более частым столкновениям молекул и, в результате, более высокой вероятности успешной реакции. Следовательно, скорость химической реакции возрастает.
Снижение давления, наоборот, увеличивает объем системы и, следовательно, разрежение газовой фазы. Это приводит к уменьшению концентрации реагентов и, как результат, уменьшению частоты столкновений. Следовательно, скорость реакции уменьшается.
Важно отметить, что влияние давления на скорость реакции может быть значительным только для реакций, в которых газы являются реагентами или продуктами. В случае жидкостей или твердых веществ, давление обычно оказывает незначительное влияние на скорость реакции, так как их объемы практически не меняются.
Давление и скорость реакции: взаимосвязь и влияние
Давление играет важную роль в химических реакциях, оказывая влияние на их скорость. Когда давление увеличивается, молекулы вещества становятся ближе друг к другу, что увеличивает вероятность успешных столкновений между ними. В результате этого увеличения вероятности столкновений, скорость реакции увеличивается.
Для лучшего понимания взаимосвязи между давлением и скоростью реакции, можно рассмотреть пример с газовой реакцией. В газах молекулы находятся в непрерывном движении и сталкиваются друг с другом. Для того, чтобы произошла реакция между газами, молекулы должны столкнуться с достаточной энергией и правильным углом.
Когда давление увеличивается, молекулы газа находятся ближе друг к другу, что увеличивает вероятность столкновений. Кроме того, давление также влияет на скорость реакции путем изменения объема или концентрации газа. Если объем газовой системы уменьшается, то количество молекул в единице объема увеличивается, что также приводит к увеличению вероятности столкновений.
Интересно отметить, что давление может оказывать не только прямое влияние на скорость реакции, но и влиять на равновесие химической системы. При изменении давления, например, путем изменения объема реакционной смеси, можно изменить состояние равновесия и скорость перемещения к равновесию.
| Увеличение давления | Влияние на скорость реакции |
|---|---|
| Увеличение вероятности столкновений молекул | Увеличение скорости реакции |
| Увеличение концентрации газа | Увеличение вероятности столкновений |
| Изменение состояния равновесия | Влияние на скорость перемещения к равновесию |
Таким образом, давление играет важную роль в химических реакциях и может оказывать существенное влияние на их скорость. Понимание взаимосвязи между давлением и скоростью реакции позволяет улучшить контроль за процессами и оптимизировать их условия проведения.
Изучение влияния давления на скорость реакции
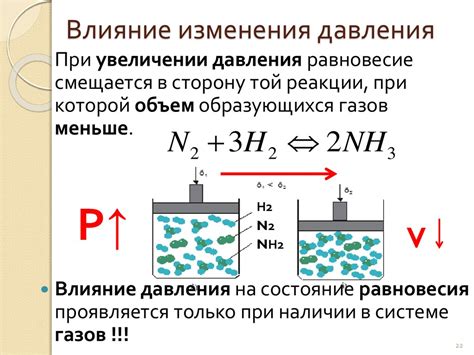
Исследования показывают, что при увеличении давления скорость реакции часто увеличивается. Это связано с тем, что увеличение давления приводит к увеличению количества столкновений между молекулами реагирующих веществ. Чем больше столкновений, тем выше вероятность успешного протекания реакции и высокая скорость.
Увеличение давления также может привести к изменению концентраций реагирующих веществ. При повышенном давлении объем газов уменьшается, что приводит к увеличению их концентрации. Более высокая концентрация газовых компонентов стимулирует частые и успешные столкновения между молекулами и ускоряет химическую реакцию.
Однако, следует отметить, что влияние давления на скорость реакции может быть различным для разных реакций. Некоторые реакции могут не зависеть от давления, а некоторые могут показывать обратную зависимость, когда повышение давления может замедлить реакцию.
Для изучения влияния давления на скорость реакции проводятся эксперименты, в которых меняются давление системы и измеряется скорость реакции. Это позволяет установить, каким образом давление влияет на данную реакцию и определить соответствующие закономерности.
Изучение влияния давления на скорость реакции является важным для понимания и оптимизации процессов в различных областях, таких как промышленность, экология, медицина и другие. Понимание этих взаимосвязей позволяет разрабатывать более эффективные катализаторы, регулировать скорость процессов и сокращать время реакции, что имеет большое значение в современном мире.
Факторы, влияющие на взаимосвязь давления и скорости реакции
Основной механизм, по которому давление влияет на скорость реакции, связан с изменениями в концентрации реагентов. Увеличение давления приводит к сжатию газовых реагентов, что увеличивает их концентрацию. Увеличение концентрации, в свою очередь, увеличивает частоту столкновений между частицами реагентов и, следовательно, увеличивает скорость реакции.
Однако, следует отметить, что влияние давления на скорость реакции зависит от типа реакции и характера реагентов. Некоторые реакции могут быть малочувствительными к изменению давления, в то время как другие реакции могут сильно зависеть от него.
Кроме того, нужно отметить, что влияние давления на скорость реакции является индивидуальным для каждой реакции. Для некоторых реакций изменение давления может увеличить скорость реакции, в то время как для других реакций оно может уменьшить ее. Поэтому при изучении конкретной реакции необходимо проводить эксперименты для определения взаимосвязи давления и скорости реакции.
Практическое применение эффекта давления на скорость химических реакций
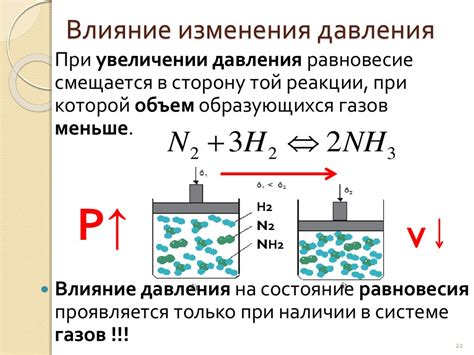
Одним из примеров практического применения эффекта давления на скорость реакций является производство аммиака. Реакция синтеза аммиака, известная как процесс Габера, является одной из наиболее широко используемых в промышленности. В этом процессе катализатором обычно выступает соединение железа, аммиачная сажа, находящаяся под высоким давлением.
Высокое давление помогает ускорить скорость реакции синтеза аммиака, что влияет на производительность процесса. Значительная часть потребляемой энергии в процессе синтеза аммиака используется для обеспечения необходимого давления. Поэтому оптимизация давления позволяет снизить энергозатраты на производство аммиака.
Другим примером практического применения эффекта давления является процесс гидрирования. Гидрирование - это химическая реакция, при которой молекулы водорода добавляются к молекулам органического соединения. Многие процессы гидрирования происходят при высоких давлениях, чтобы ускорить реакцию.
Применение давления также важно в фармацевтической промышленности. Многие процессы синтеза лекарственных веществ требуют высоких давлений, чтобы достичь нужной скорости реакции. Контролируемое давление позволяет повысить эффективность производства лекарств и сократить время процесса.
Также давление может играть роль в процессах получения энергии. Например, гидротермальная энергия позволяет использовать высокое давление под землей для производства электроэнергии.
Все эти примеры показывают, что практическое применение эффекта давления на скорость реакций имеет важное значение в различных отраслях промышленности, фармацевтике и энергетике. Понимание этого эффекта позволяет разрабатывать и оптимизировать процессы, что приводит к улучшению качества и эффективности производства различных продуктов.