Азот – химический элемент, который обладает множеством уникальных свойств. Одним из них являются его окислительные свойства. Многие люди считают, что азот не может выступать в качестве окислителя, однако это утверждение является неверным.
Окислительные свойства азота проявляются в результате его способности получать электроны при контакте с другими веществами. Азот может вступать в реакцию с различными элементами, переходя в более высокую степень окисления. Это приводит к образованию оксидов азота, таких как азотная кислота (HNO3) или оксид азота (NO).
Особенно ярким примером окислительных свойств азота является его способность вступать в реакцию с металлами. При этом металл окисляется, а азот превращается в оксид азота. Например, реакция азота с железом приводит к образованию оксида азота и оксида железа. Такие процессы широко используются в различных промышленных отраслях.
Таким образом, суждение о том, что азот не обладает окислительными свойствами, является ошибочным. Окислительные свойства азота проявляются в его способности получать электроны при вступлении в реакции с другими веществами. Это делает азот важным и универсальным окислителем в химических процессах и применениях в промышленности.
Окислительные свойства азота и их суждения

Азот относится к химическим элементам, которые проявляют окислительные свойства в определенных условиях. Это означает, что азот может образовывать соединения, в которых он может передавать электроны другим элементам, окисляя их.
Однако, следующие суждения об окислительных свойствах азота являются неверными:
- Азот обладает только положительными окислительными свойствами. На самом деле, азот может проявлять как положительные, так и отрицательные окислительные свойства в различных соединениях. Например, в аммиаке (NH3) азот имеет отрицательное окислительное состояние, а в нитратных и нитритных соединениях (NO3-, NO2-) - положительное.
- Азот не может окислиться при образовании азотной кислоты (HNO3). На самом деле, азот в азотной кислоте имеет положительное окислительное состояние (+5) и активно окисляет другие элементы в присутствии соответствующих условий.
- Азот не может вступать в противоречие с окислительными свойствами. Это неверное утверждение, так как азот может одновременно проявлять и окислительные, и восстановительные свойства в зависимости от окружающих условий и взаимодействия с другими веществами.
Окислительные свойства азота являются важной составляющей во многих химических реакциях и играют существенную роль в различных процессах в природе и промышленности.
Азот действует как окислитель в некоторых условиях

Когда азот взаимодействует с алкалиями, как натрий (Na) или калий (K), он может претерпеть окислительное действие. Например, реакция между азотом и нодием может быть представлена как:
- 2Na + N2 → 2NaN
Эта реакция показывает, что азот принимает электроны от натрия и окисляет его до иона NaN.
Кроме того, азот может действовать как окислитель в некоторых реакциях с металлами. Например, когда азот взаимодействует с медью (Cu), он окисляет ее до оксида меди (CuO). Эта реакция может быть представлена следующим образом:
- 2Cu + N2 → 2CuO
Этот процесс показывает, что азот принимает электроны от меди и окисляет ее до оксида меди.
Таким образом, в определенных условиях азот может действовать как окислитель и принимать электроны от других веществ. Это позволяет ему участвовать в различных окислительных реакциях.
Суждение: Азот всегда является окислителем
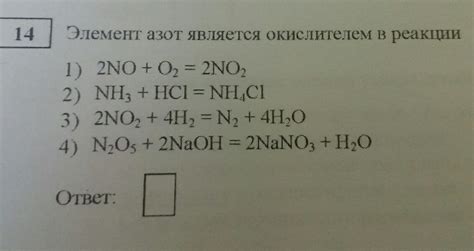
Азот, как правило, обладает малой активностью в реакциях окисления. Например, в атмосферном воздухе азот является инертным газом и не проявляет свойств окисления. Однако, в некоторых экзотермических реакциях азот может быть окислителем, передавая электроны другому реагенту.
Также следует отметить, что окислительные свойства азота могут быть усилены в определенных условиях, когда азот соединяется с другими элементами, например, с кислородом или фтором. В таких соединениях азот способен выступать в роли окислителя, принимая на себя электроны.
Важно понимать, что окислительность азота не является его неизменным свойством и может проявляться только в определенных условиях реакции.
Суждение: Окислительные свойства азота зависят от условий

В обычных условиях, азот образует стабильные двойные связи в молекулах азота (N2), что делает его практически нереактивным.
Однако, при повышенных температурах или в присутствии катализаторов, азот может проявлять окислительные свойства. Например, при высокой температуре азот может реагировать с кислородом и образовывать оксид азота. Эта реакция является одной из основных причин образования азотистых оксидов (NOx), которые являются важными загрязнителями атмосферы.
Также, азот может реагировать с некоторыми металлами, образуя соответствующие нитриды. Например, азот может взаимодействовать с магнием и образовывать нитрид магния (Mg3N2), который используется в производстве удобрений.
Окислительные свойства азота зависят от конкретных условий реакции, таких как температура, присутствие катализаторов и концентрация других веществ. Поэтому, азот может проявлять как окислительные, так и восстановительные свойства в различных химических реакциях.
Важно отметить, что окислительные свойства азота необходимо учитывать при разработке технологий и процессов, связанных с использованием и обработкой азота, чтобы предотвратить негативные последствия его реакций.
Суждение: Азот не может проявлять окислительные свойства

Одним из примеров таких соединений является азотная кислота (HNO3). Она является сильным окислителем и может окислять многие вещества, в том числе металлы.
Еще одним примером является аммиак (NH3), который может окисляться до более высоких окислительных состояний, образуя соединения типа гидроксида аммония (NH4OH).
Также азот может вступать в реакции с кислородом, образуя азотистый оксид (NO), который может дальше окисляться до азотного диоксида (NO2) и других высших оксидов азота.
Таким образом, азот способен проявлять окислительные свойства и взаимодействовать с другими веществами с образованием соединений с более высоким окислительным состоянием.