Электролиты - это вещества, которые в растворе образуют ионы - заряженные частицы. Ионы могут быть положительными или отрицательными, и именно они отвечают за проводимость электрического тока в растворах. Многие считают, что электролиты только в растворенном состоянии могут образовывать ионы, но это глубоко ошибочное мнение.
На самом деле вещества уже в их чистом состоянии содержат ионы. Посмотрим на пример натрия (Na) и хлора (Cl). Обычно их встречают в виде кристаллической соли - хлорида натрия (NaCl). В таком виде они не проводят электрический ток, так как ионы заморожены в кристаллической решетке. Но при растворении хлорида натрия в воде эта решетка разрушается и ионы Na+ и Cl- освобождаются, становясь подвижными и способными проводить ток. Также электролитические свойства проявляет растворенная кислота или щелочь, иных веществ и, конечно, растворы электролитов.
Ионы - это заряженные частицы, образующиеся в результате диссоциации веществ или передачи электронов. Они могут быть одноатомными, например, Na+ или Cl-, или же многоатомными. Примером последних могут служить ионы NH4+ (ион аммония) или SO42- (ион сульфата). Ионы играют важную роль в жизнедеятельности клеток, тканей и организмов в целом, так как участвуют в химических реакциях, передаче нервных импульсов и поддержании баланса воды и электролитов.
Различные суждения о электролитах и ионах могут быть ошибочными. Например, некоторые люди думают, что только соли могут быть электролитами, однако это не так. Кислоты, щелочи и многие другие вещества также могут образовывать ионы в растворах и проводить электрический ток. Также неправильно считать, что ионы могут быть только положительными или отрицательными - многое зависит от химического состава вещества и его реакционных свойств. Важно разобраться в этих моментах, чтобы правильно понимать и использовать наши знания о электролитах и ионах в повседневной жизни.
Мифы и правда об электролитах и ионах

Правда: Не все вещества, которые проводят электрический ток, являются электролитами, а именно - только растворы и расплавы, в которых присутствуют свободные ионы. Более того, некоторые чистые вещества, такие как металлы, также обладают способностью проводить электрический ток, но ионная структура в них отсутствует.
Миф: Ионы всегда образуются только в водных растворах.
Правда: Ионы могут образовываться не только в водных растворах, но и в других типах растворителей, таких как спирты, кислоты, щелочи и другие. Вещества, которые образуют свободные ионы в растворе, называются электролитами.
Миф: Ионы всегда имеют электрический заряд.
Правда: Не все ионы имеют электрический заряд. Если ион имеет положительный заряд, он называется катионом, а если отрицательный - анионом. Однако существуют также нейтральные ионы, которые не имеют электрического заряда.
Миф: Электролиты всегда имеют жидкую или газообразную форму.
Правда: Электролиты могут иметь разные формы, не только жидкую или газообразную, но и твердую. Например, многие плавильные соли обладают способностью проводить электрический ток в расплавленном состоянии.
Электролиты - что это такое?

Электролиты могут быть как неорганическими, так и органическими веществами. Неорганические электролиты включают в себя растворы солей, кислот и оснований. Органические электролиты представлены различными органическими соединениями, включая жиры, белки и углеводы.
В растворах электролиты диссоциируют на ионы, что позволяет им проводить электрический ток. При этом, положительно заряженные ионы перемещаются к катоду, а отрицательно заряженные - к аноду.
Электролиты играют важную роль во многих процессах в организмах живых организмов. Они участвуют в передаче нервных импульсов, сокращении мышц, регуляции осмотического давления. Также электролиты необходимы для обменных процессов и поддержания кислотно-щелочного баланса.
Важно отметить, что электролиты должны находиться в организме в определенном балансе, чтобы все процессы происходили правильно. Нарушение баланса электролитов может привести к различным заболеваниям и состояниям, таким как дефицит или избыток некоторых ионов.
Различные виды электролитов
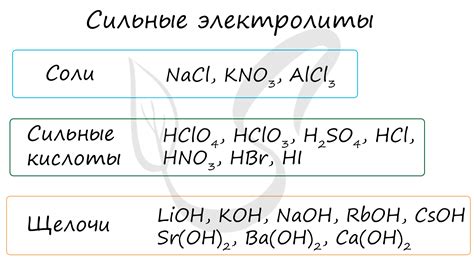
- Бинарные электролиты: включают в себя ионы, состоящие только из двух элементов. Примерами бинарных электролитов являются хлорид натрия (NaCl) и сульфат магния (MgSO4).
- Трехкомпонентные электролиты: содержат ионы, состоящие из трех элементов. Некоторые трехкомпонентные электролиты могут включать ионы кислоты, ионы основания и ионы солей. Примером трехкомпонентного электролита является соляная кислота (HCl), содержащая ионы водорода (H+), ионы хлорида (Cl-) и ионы воды (H2O).
- Поликарбоксилатные электролиты: включают в себя ионы, состоящие из нескольких элементов, связанных вместе с помощью карбоксильной группы. Примером поликарбоксилатного электролита является этилендиаминтетрауксусная кислота (EDTA), используемая в медицинских и лабораторных целях.
- Органические электролиты: содержат органические молекулы, которые способны образовывать ионы в растворе. Примерами органических электролитов являются аминокислоты, используемые в питании, и органические соли, используемые в лекарствах и косметике.
Каждый из этих видов электролитов имеет свои особенности и применяется в различных отраслях науки и промышленности.
Факты и мифы об ионах

- Миф: Ионы являются вредными веществами, которые необходимо избегать. Факт: Ионы присутствуют во многих естественных и искусственных веществах, и их присутствие не всегда является вредным. Например, некоторые ионы могут быть необходимы для жизни человека и других организмов.
- Миф: Ионы могут вызывать рак. Факт: В некоторых случаях определенные ионы могут быть опасными и могут играть роль в развитии рака. Вместе с тем, не все ионы являются потенциально опасными, и воздействие ионов на здоровье зависит от их концентрации и других факторов.
- Миф: Ионы всегда имеют положительный заряд. Факт: Ионы могут иметь как положительный, так и отрицательный заряд. Ионы с положительным зарядом называются катионами, а с отрицательным зарядом – анионами.
- Миф: Ионы не могут свободно перемещаться в веществе. Факт: Ионы способны свободно перемещаться в растворах или проводников, таких как металлы или электролиты. Этот процесс, называемый ионной проводимостью, играет важную роль в различных химических и физических процессах.
Зависимость проводимости от концентрации
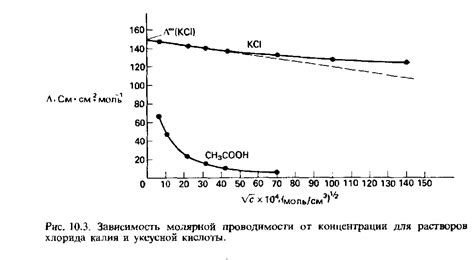
Проводимость электролитов зависит от их концентрации. Чем больше концентрация электролита, тем больше ионов находится в растворе, и, следовательно, тем лучше электролит проводит электрический ток.
Если концентрация электролита увеличивается, то количество ионов в растворе также увеличивается, а значит, возрастает проводимость электролита. Ионы движутся в растворе, образуя электрический ток. Таким образом, при увеличении концентрации электролита, его электропроводность повышается.
Также стоит отметить, что при низкой концентрации электролита, количество ионов в растворе будет незначительным, и проводимость электролита будет слабой. В таком случае, электролит будет проводить электрический ток слабо или вовсе не проводить.
Это явление объясняется тем, что для проведения электрического тока необходимо наличие свободных заряженных частиц (ионов) в растворе. Чем больше концентрация электролита, тем больше свободных ионов, и тем лучше он проводит электрический ток.
Положительные и отрицательные ионы
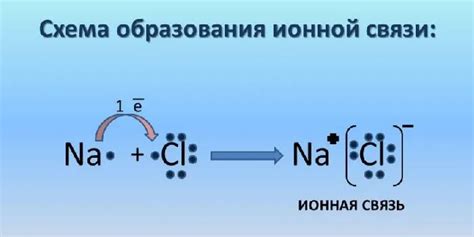
Наиболее распространенным положительным ионом является ион водорода (H+), который образуется при потере электрона. Также в качестве катионов могут выступать ионы металлов, такие как натрий (Na+), калий (K+), кальций (Ca2+) и др.
Анионы, напротив, имеют отрицательный заряд и образуются, когда атом или группа атомов приобретают один или несколько электронов. Один из наиболее распространенных отрицательных ионов - гидроксидный ион (OH-), который образуется при приобретении электрона. Другими примерами анионов являются хлоридный (Cl-), нитратный (NO3-), ацетатный (CH3COO-) и др.
Ионы играют важную роль в химических реакциях и обладают определенными свойствами, которые зависят от их заряда и других факторов. Например, катионы и анионы могут притягиваться друг к другу и образовывать ионные связи. Также ионы могут иметь разные степени растворимости в воде и влиять на электропроводность растворов.
Электролиты в быту и в природе

В быту мы сталкиваемся с электролитами каждый день. Одним из примеров является питьевая вода. Вода из-под крана или бутилированная вода часто содержат микроэлементы, такие как натрий, калий и кальций, которые делают ее электролитной. Эти электролиты необходимы для правильного функционирования организма и поддержания гомеостаза.
Электролиты также находятся в различных напитках и продуктах питания. Например, спортивные напитки содержат электролиты, такие как натрий и калий, которые помогают восстановить баланс веществ после физической активности. Фрукты и овощи также содержат электролиты, в том числе калий и магний.
В природе электролиты также играют важную роль. Многие природные водные источники, такие как озера и реки, содержат электролиты. Кроме того, морская вода сама по себе является электролитом, так как содержит различные минералы и соли. Морские экосистемы зависят от содержания электролитов и создают благоприятную среду для живых организмов.
Важно отметить, что хотя электролиты являются необходимыми для нашей жизни, излишек или недостаток электролитов в организме может вызывать негативные последствия. Поэтому важно поддерживать баланс электролитов путем правильного питания и приема достаточного количества воды.
| Электролиты в быту | Электролиты в природе |
|---|---|
| Питьевая вода | Морская вода |
| Спортивные напитки | Озера и реки |
| Фрукты и овощи | Минералы и соли |
Влияние электролитов на организм

Одним из наиболее важных электролитов для организма является натрий. Он участвует в регуляции внутриводного равновесия и поддержании нормального кровяного давления. Недостаток или избыток натрия может привести к различным проблемам, включая отеки, депрессию, аритмию сердца и повышенное давление.
Калий - еще один важный электролит, ответственный за правильную работу сердца, мышц и нервной системы. Недостаток калия может вызвать мышечные слабости, нарушения сердечного ритма и даже паралич. Повышенный уровень калия в крови также может привести к серьезным проблемам, включая нарушения работы сердца и почек.
Кальций - важный электролит, необходимый для поддержания здоровых костей и зубов. Он также играет важную роль в сократительной функции мышц и нормализации сосудистого тонуса. Недостаток кальция может привести к остеопорозу, а повышенный уровень кальция в крови может вызвать образование камней в почках.
Магний - важный электролит, участвующий в более чем 300 биохимических реакциях в организме. Он играет важную роль в синтезе ДНК и РНК, обеспечении энергетического обмена и функционировании нервной и мышечной системы. Недостаток магния может привести к нервным нарушениям, мышечным судорогам и нарушениям сердечного ритма.
Фосфор - еще один важный электролит, необходимый для правильного функционирования организма. Он участвует в образовании и регулировании молекул АТФ, которые являются основным источником энергии для клеток. Недостаток фосфора может привести к ослаблению мышц, нарушениям пищеварения и проблемам со здоровьем костей.
В целом, электролиты являются важными компонентами организма и их недостаток или избыток может привести к различным проблемам со здоровьем. Поэтому важно поддерживать правильный баланс электролитов в организме путем правильного питания и употребления достаточного количества воды.