Гибридизация атомов углерода - это процесс, который позволяет атому углерода изменить свое электронное строение. Гибридизация происходит в результате формирования новых гибридных орбиталей, в которых электроны становятся равнозначно распределенными.
Значение гибридизации заключается в том, что она позволяет атому углерода образовывать химические связи с другими атомами, что, в свою очередь, позволяет образовывать разнообразные органические соединения. Это является основой для построения молекулярных структур и определения их физических и химических свойств.
Гибридизация атомов углерода имеет несколько видов - sp, sp2 и sp3. Гибридизация sp характеризуется образованием одной гибридной орбитали и двух p-орбиталей. Гибридизация sp2 - это образование трех гибридных орбиталей и одной p-орбитали. Конечно, гибридизация sp3 характеризуется образованием четырех гибридных орбиталей и одной s-орбитали.
Определение гибридизации атомов углерода имеет широкое практическое значение в химии. Оно помогает понять структуру органических молекул, предсказать их свойства и взаимодействия с другими веществами. Изучение гибридизации атомов углерода является важным шагом в основах органической химии и играет существенную роль в различных областях науки и промышленности, включая фармацевтику, полимеры, нефтехимию и многое другое.
Что такое гибридизация атомов углерода?

Гибридизация позволяет атому углерода изменить структуру своей оболочки и приобрести дополнительные гибридные орбитали. Это позволяет атому углерода образовывать связи с другими атомами и образовывать различные химические соединения.
Существует несколько типов гибридизации атомов углерода, включая sp, sp2 и sp3. Каждый тип гибридизации имеет свои особенности и позволяет атому углерода образовывать различные типы связей с другими атомами, такие как одинарные, двойные и тройные связи.
Гибридизация атомов углерода является важным процессом в органической химии, так как она определяет структуру и свойства органических соединений. Знание о гибридизации атомов углерода позволяет понимать, как формируются и взаимодействуют органические молекулы, и является основой для изучения органической химии.
| Тип гибридизации | Описание | Примеры |
|---|---|---|
| sp | Один s-орбитальный и один p-орбитальный электрон перераспределяются и образуют две sp-гибридные орбитали. Молекулы с гибридизацией sp образуют одинарные связи. | Метан (CH4), этилен (C2H4) |
| sp2 | Один s-орбитальный и два p-орбитальных электрона перераспределяются и образуют три sp2-гибридные орбитали. Молекулы с гибридизацией sp2 образуют двойные связи. | Бензол (C6H6), этен (C2H2) |
| sp3 | Один s-орбитальный и три p-орбитальных электрона перераспределяются и образуют четыре sp3-гибридные орбитали. Молекулы с гибридизацией sp3 образуют тройные связи. | Метанол (CH3OH), эта-н (C2H6) |
Определение гибридизации

Определение гибридизации атомов углерода включает определение количества и типов гибридных орбиталей, которые образовываются в результате гибридизации. Например, гибридизация sp3 образует четыре гибридные орбитали, каждая из которых содержит по одному электрону. Гибридизация sp2 образует три гибридные орбитали, две из которых содержат по одному электрону, а одна не гибридизованная p-орбиталь остается с тремя электронами.
Значение гибридизации атомов углерода заключается в том, что она позволяет атомам углерода образовывать различные типы связей и структур с другими атомами. Благодаря гибридизации углеродные атомы способны образовывать одиночные, двойные и тройные связи, а также образовывать кольца и цепочки, что открывает дорогу для образования бесчисленного множества органических соединений.
Виды гибридизации углерода
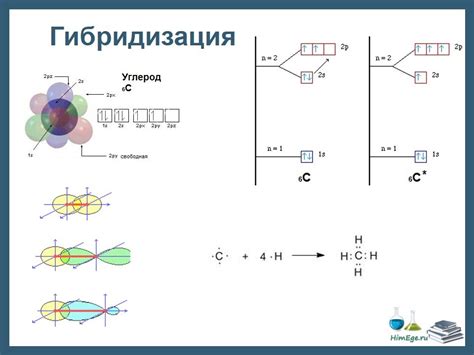
Существует несколько различных видов гибридизации углерода, которые определяются количеством гибридных орбиталей, образованных из электронных орбиталей s и p атома углерода. Наиболее распространенные виды гибридизации углерода включают:
- sp – гибридизация, при которой образуются две гибридные орбитали sp, обладающие линейной геометрической структурой. Этот тип гибридизации встречается, например, в алканах.
- sp2 – гибридизация, при которой образуются три гибридных орбитали sp2, располагающиеся в одной плоскости и имеющие угловую геометрическую структуру. Этот тип гибридизации характерен для алкенов и алкинов.
- sp3 – гибридизация, при которой образуются четыре гибридные орбитали sp3, имеющие форму тетраэдра. Этот тип гибридизации встречается, например, в метане и этилене.
Каждый из этих видов гибридизации углерода обладает своими химическими свойствами и может образовывать различные типы химических связей. Знание видов гибридизации углерода позволяет лучше понять структуру и свойства органических соединений.
Связи между атомами углерода
Гибридизация - это процесс, при котором электронные орбитали атомов переорганизуются, образуя новые гибридные орбитали. В результате этого процесса образуются четыре гибридные орбитали, которые могут быть использованы для образования четырех связей с другими атомами.
Углерод может образовывать три типа гибридизации: гибридизацию sp3, гибридизацию sp2 и гибридизацию sp. Гибридизация sp3 образуется, когда одна s-орбиталь и три p-орбитали атома углерода сливаются, образуя четыре гибридных орбитали, каждая из которых может образовывать связь с другим атомом.
Гибридизация sp2 возникает, когда одна s-орбиталь атома углерода и две p-орбитали сливаются, образуя три гибридные орбитали, каждая из которых может образовывать связь с другим атомом. Это типично для двойных связей в органических соединениях.
Гибридизация sp возникает, когда одна s-орбиталь атома углерода и одна p-орбиталь сливаются, образуя две гибридные орбитали, каждая из которых может образовывать связь с другим атомом. Это типично для тройных связей в органических соединениях.
Связи между атомами углерода могут быть одинарными, двойными или тройными в зависимости от типа гибридизации и количества гибридных орбиталей, используемых для образования связи. Это позволяет углероду образовывать разнообразные структуры и соединения, имеющие различные свойства и функции в органической химии.
Значение гибридизации атомов углерода

Одной из самых распространенных форм гибридизации углерода является гибридизация sp3. В этом случае гибридизуются одна s-орбиталь и три p-орбитали углерода, формируя четыре гибридных sp3-орбитали. Этот тип гибридизации характерен для атомов углерода в метане, этиловом спирте и большинстве других органических соединений.
| Формула органического соединения | Тип гибридизации атомов углерода |
|---|---|
| Метан (CH4) | sp3 |
| Этанол (C2H6O) | sp3 |
| Метиловый спирт (CH3OH) | sp3 |
Гибридизация также может включать гибридизацию sp2 и sp атомов углерода. Гибридизация sp2 включает гибридизацию одной s-орбитали и двух p-орбиталей углерода, образуя три гибридных sp2-орбитали. Этот тип гибридизации встречается в алкенах и алканах.
Гибридизация sp характерна для углерода в алкинах, где одна s-орбиталь и одна p-орбиталь гибридизуются, образуя две гибридные sp-орбитали.
Гибридизация атомов углерода позволяет им формировать разнообразные связи и образовывать сложные структуры органических соединений. Это является основой понимания химических реакций и свойств многих соединений, и имеет значительное значение в области органической химии.
Примеры гибридизации углерода

Гибридизацию атомов углерода можно наблюдать в различных соединениях, образующихся в органической химии. Вот несколько примеров типов гибридизации:
1. Гибридизация sp
Этот тип гибридизации встречается, например, в ацетилене (C2H2). Атомы углерода в ацетилене образуют двойную связь, а для этого происходит гибридизация 2s- и 2p-орбиталей. Каждая атомная орбиталь углерода сначала гибридизуется, образуя две sp-гибридизованные орбитали, и затем одна из орбиталей сольется с атомной орбиталью другого углерода, создавая σ-связь, а другая орбиталь будет свободной и образует π-связь. Такое расположение электронных пар делает ацетилен химически активным и реакционноспособным соединением.
2. Гибридизация sp2
Примером гибридизации sp2 является молекула этилена (C2H4). В этилене, каждый атом углерода образует по две связи с другим углеродом и по одной σ-связи с атомами водорода. Гибридизация sp2 происходит путем смешивания 2s- и двух 2p-орбиталей. Гибридные орбитали образуют плоскостное расположение атомов углерода и придают молекуле этилена его особенные химические свойства, такие как конъюгирование и плоское строение.
3. Гибридизация sp3
Наиболее распространенной формой гибридизации углерода является sp3. Примерами молекул с гибридизацией sp3 являются метан (CH4) и этиловый спирт (C2H5OH). В молекуле метана, каждый атом углерода образует четыре σ-связи с атомами водорода, и все орбитали углерода гибридизуются путем смешения одной 2s- и трех 2p-орбиталей. Гибридизация sp3 обеспечивает молекуле метана своеобразную форму тетраэдра и делает ее неполярной.
Как видно из этих примеров, гибридизация атомов углерода играет важную роль в органической химии и определяет химические свойства соединений, которые они образуют.
Роль гибридизации в органической химии

Гибридизация атомов углерода позволяет иметь определенную геометрию молекулы, что влияет на ее химические и физические свойства. Например, сп^3-гибридизация углерода приводит к образованию тетраэдрической структуры, что делает молекулу более устойчивой и позволяет ей образовывать связи с другими атомами.
Гибридизация также позволяет атому углерода образовывать различные виды связей, такие как σ- и π-связи. Эти связи играют важную роль в определении химической активности и реакционной способности органических соединений.
Кроме того, гибридизация атомов углерода определяет стерические эффекты, то есть влияние замещающих групп на пространственное строение молекулы. Это может влиять на реакционную способность и молекулярную конформацию органических соединений.
Таким образом, гибридизация атомов углерода играет ключевую роль в органической химии, определяя структуру и свойства органических соединений. Понимание этого процесса позволяет химикам исследовать и модифицировать органические соединения для создания новых материалов с желаемыми свойствами и приложениями.