Серная кислота (H2SO4) – это безцветная жидкость с характерным запахом, которая широко используется в промышленности. Она является одним из самых сильных кислотных веществ, и ее применение в различных процессах связано с ее способностью выступать в качестве электролита.
Электролиты - это химические вещества, способные проводить электрический ток в растворе или плавике. Они разделяются на две категории: сильные электролиты и слабые электролиты. Сильные электролиты полностью ионизируются в растворе, образуя положительно и отрицательно заряженные ионы. Слабые электролиты ионизируются только частично, оставаясь в основном в форме ненейтральных молекул.
Когда серная кислота растворяется в воде, она диссоциирует на ионы водорода (H+) и сульфатные ионы (SO4^2-). Оба этих иона являются заряженными и способны проводить электрический ток. Поэтому, серная кислота считается сильным электролитом, поскольку она полностью ионизируется в растворе и обладает способностью проводить электрический ток.
Серная кислота: электролит или нет?

Определение электролита заключается в том, что в растворе эта вещество диссоциирует на ионы, которые принимают участие в проведении электрического тока. В случае с серной кислотой, она является сильной кислотой и полностью диссоциирует в водном растворе.
Ионы, образующиеся при диссоциации серной кислоты, включают гидрононы и сульфатные ионы. Гидрононы (H+) являются катионами, а сульфатные (SO42-) - анионами.
Таким образом, серная кислота является электролитом, так как она образует ионы в водном растворе и может проводить электрический ток.
Роль серной кислоты в химических реакциях

Серная кислота является сильным кислотным соединением и полностью диссоциирует в водном растворе на ионы водорода (H⁺) и сульфатные ионы (SO₄²⁻). Благодаря этой способности серной кислоты быть электролитом, она может участвовать в различных реакциях и играть важную роль в химических процессах.
Одной из главных ролей серной кислоты является каталитическое воздействие во многих реакциях. Она может ускорять химические превращения, способствуя разложению и синтезу различных соединений. Серная кислота также может быть использована в качестве катализатора при эффективном превращении органических соединений, таких как эфиры, альдегиды и кетоны.
Кроме того, серная кислота может выполнять роль дегидратирующего агента в реакциях. Она способна вытягивать воду из других веществ, что позволяет осуществить реакции дегидратации. Это свойство серной кислоты находит применение в процессах получения эфиров, высокоочищенных органических соединений и других важных химических продуктов.
Кроме того, серная кислота широко применяется в качестве реагента при получении различных соединений. Она может быть использована для синтеза нитроксидов, атионов, сульфатов и других соединений. Благодаря своей сильной кислотности и высокой реакционной способности, серная кислота является одним из основных инструментов в химическом производстве.
Свойства серной кислоты

Кислотность:
Серная кислота является сильным кислотным соединением. Она может диссоциировать в воде, образуя два иона водорода (H+) и один ион сульфата (SO42-). Благодаря этому свойству, серная кислота обладает высокой кислотностью и способна реагировать с основаниями, образуя соли.
Окислительные свойства:
Серная кислота также обладает окислительными свойствами. Она способна окислять многие вещества, в том числе металлы, некоторые неорганические соединения и органические вещества. Это свойство позволяет использовать серную кислоту в процессах окисления и приготовлении ряда химических соединений.
Коррозионные свойства:
Серная кислота является очень коррозивным веществом. Она способна разрушать многие материалы, в том числе металлы и некоторые полимеры. Поэтому при работе с серной кислотой необходимо соблюдать особые меры предосторожности и использовать специальные материалы, устойчивые к ее действию.
Электролитические свойства:
Серная кислота является электролитом, то есть она может проводить электрический ток в растворе. Это свойство обусловлено диссоциацией кислоты на ионы в воде. Поэтому серная кислота может быть использована в электрохимических процессах и в электролитических ячейках.
Все эти свойства делают серную кислоту важным веществом в химической промышленности, лабораторных исследованиях и других областях науки и технологии.
Электролитные свойства серной кислоты
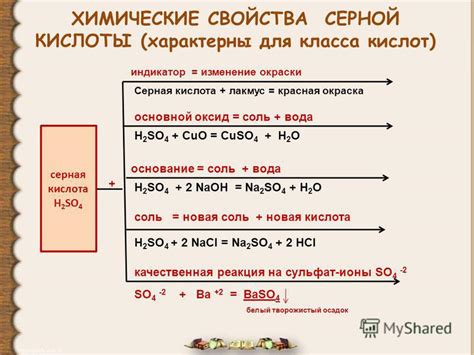
Серная кислота (H2SO4) обладает электролитными свойствами, что означает, что она может проводить электрический ток в растворе.
В водном растворе молекулы серной кислоты диссоциируют, образуя ионы водорода (H+) и сульфатные ионы (SO42-). Эти ионы, находясь в растворе, способны перемещаться и обеспечивать проводимость раствора.
Серная кислота относится к сильным кислотам и полностью диссоциирует в воде, что значит, что все ее молекулы распадаются на ионы. Это делает серную кислоту эффективным электролитом.
Особенности электролитных свойств серной кислоты делают ее полезным в различных промышленных процессах и лабораторных исследованиях.