В химии основными оксидами называют соединения, которые образуются при соединении элементов с кислородом. Они обладают выраженными основными свойствами и способны реагировать с кислотами, образуя соли и воду. Но что происходит, когда основные оксиды вступают в реакцию друг с другом?
При взаимодействии двух основных оксидов происходит реакция синтеза, в результате которой образуется новое соединение. В зависимости от конкретных условий и реагентов, могут образовываться различные продукты реакции. Например, реакция между щелочным оксидом калия (K2O) и щелочным оксидом натрия (Na2O) приводит к образованию основы - гидроксида калия (KOH) и гидроксида натрия (NaOH).
Основные оксиды могут также реагировать между собой по типу взаимодействия кислот и щелочей, образуя соли и воду. Например, реакция между щелочным оксидом натрия (Na2O) и оксидом алюминия (Al2O3) приводит к образованию соли - сульфата натрия (Na2SO4) и воды.
Таким образом, реакция между основными оксидами может приводить к образованию разнообразных продуктов, включая гидроксиды и соли. Изучение этих реакций позволяет лучше понять основные свойства оксидов и их химическую активность.
Реакция между основными оксидами: что происходит при взаимодействии?

При взаимодействии основных оксидов между собой происходит образование солей. Эта реакция называется нейтрализационной реакцией, так как основной оксид выступает в роли основания, а второй основный оксид выступает в роли кислоты.
Например, при взаимодействии оксида натрия (Na2O) и оксида магния (MgO) образуется соль натрия и магния (NaMgO). Эта реакция происходит в результате обмена ионами: ион натрия (Na+) образует связь с ионом оксида (O-2) от оксида магния, в то время как ион магния (Mg2+) образует связь с ионом оксида от оксида натрия.
Реакция между основными оксидами играет важную роль в промышленных процессах, а также в природных процессах. Например, в природе реакция между оксидами кальция (CaO) и кремния (SiO2) является основной реакцией при образовании породы, такой как гранит или базальт.
Таким образом, реакция между основными оксидами является важным процессом, который способствует образованию новых соединений и играет значительную роль в различных сферах нашей жизни.
Происхождение основных оксидов и их свойства

Основные оксиды образуются в результате реакции металлов с кислородом или реагентами, содержащими кислород, такими как кислоты или пероксиды. Как правило, металлы, имеющие низкие электроотрицательности, образуют основные оксиды. Эти оксиды обладают щелочными свойствами и растворяются в воде, образуя щелочные растворы.
Основные оксиды обладают следующими свойствами:
| Свойство | Описание |
|---|---|
| Щелочные свойства | Основные оксиды образуют щелочные растворы при реакции с водой. Щелочные растворы обладают нейтрализующими свойствами и могут использоваться в качестве основы. |
| Ионизация | Основные оксиды образуют гидроксиды металлов при растворении в воде. Гидроксиды металлов образуют ионы гидроксида (OH-) и ионы металла, придающие раствору основные свойства. |
| Устойчивость | Основные оксиды обладают высокой устойчивостью к высоким температурам и химическим реакциям. Они могут использоваться в качестве катализаторов или в процессах производства промышленных химических соединений. |
Образование и свойства основных оксидов играют важную роль в химической промышленности и лабораторной практике. Они широко используются в производстве стекла, керамики, металлургии и других отраслях промышленности.
Химическая реакция между основными оксидами

Основные оксиды представляют собой химические соединения, которые образуются при соединении металлов с кислородом. К этим соединениям относятся, например, оксиды щелочных металлов (натрия, калия и др.), а также оксиды щелочноземельных металлов (кальция, магния и др.).
При взаимодействии основных оксидов происходит химическая реакция, в результате которой образуются основания. Основания – это соединения, которые образуются при растворении основных оксидов в воде. При этом основные оксиды реагируют с молекулами воды и образуют ионы гидроксида и ионы катиона металла.
Для примера рассмотрим реакцию между оксидом натрия (Na2O) и водой (H2O). В результате этой реакции образуется натриевый гидроксид (NaOH).
| Исходные вещества: | Реакционная формула: | Конечная продукция: |
|---|---|---|
| Оксид натрия (Na2O) | Na2O + H2O | НаOH |
Таким образом, реакция между основными оксидами и водой приводит к образованию оснований, которые могут быть использованы для различных химических процессов и применений. Кроме того, такие реакции являются основой для понимания взаимодействия основных оксидов с другими соединениями и веществами.
Образование солей при взаимодействии основных оксидов с кислотами

Процесс образования солей при взаимодействии основных оксидов с кислотами можно представить в виде следующего уравнения:
Оксид + Кислота → Соль + Вода
В реакции участвуют ионообразующиеся компоненты основных оксидов и кислот. Катионом соли становится металл, находящийся в составе основного оксида, а анионом - остаток кислоты.
Образовавшаяся соль может существовать как твердое вещество, растворяться в воде или образовывать осадок при наличии необходимых условий, таких как изменение pH или температурные изменения.
В результате образования солей при взаимодействии основных оксидов с кислотами происходит нейтрализация, что означает, что кислота и основание (или оксид) полностью реагируют друг с другом, образуя соль и воду. Эта реакция имеет широкое применение в таких областях, как химическая промышленность, фармацевтика и производство удобрений.
Использование реакции основных оксидов для получения солей
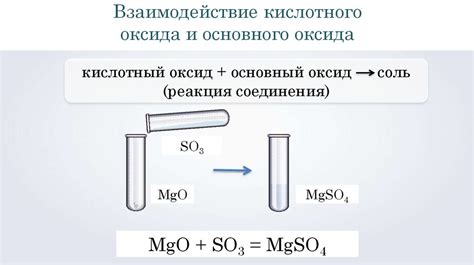
Основные оксиды представляют собой соединения металлов с кислородом. Эти соединения обладают щелочными свойствами и растворяются в воде с образованием гидроксидов, которые являются основаниями.
Реакция между основными оксидами и кислотами проходит с образованием соли и воды. При этом ионы металла из оксида оказываются связанными с ионами кислоты в виде соли, а ионы гидроксида превращаются в молекулы воды.
Например, реакция между оксидом натрия (Na2O) и серной кислотой (H2SO4) приводит к образованию соли сульфата натрия (Na2SO4) и воды:
Na2O + H2SO4 → Na2SO4 + H2O
Таким образом, реакция основных оксидов с кислотами позволяет получать различные соли, которые широко используются в химической промышленности и в повседневной жизни.
Влияние окружающей среды на силу реакции между основными оксидами

Влияние окружающей среды на силу реакции между основными оксидами может быть значительным. Окружающая среда может оказывать как положительное, так и отрицательное влияние на скорость и интенсивность реакции.
Одним из факторов, влияющих на силу реакции, является температура окружающей среды. При повышении температуры скорость реакции обычно увеличивается, так как это приводит к увеличению количества энергии частиц и их активности. В некоторых случаях, при очень высоких температурах, реакция может протекать так быстро, что сопровождается сильным выбросом энергии и образованием пламени.
Кроме температуры, на силу реакции могут влиять и другие факторы окружающей среды, такие как давление и наличие катализаторов. Давление оказывает влияние на реакцию, так как при повышенном давлении количество частиц в единице объема увеличивается, что может ускорить реакцию. Катализаторы, в свою очередь, ускоряют химическую реакцию, разрушая определенные химические связи и снижая энергию активации.
Окружающая среда может также влиять на реакцию между основными оксидами путем изменения реакционной среды. Например, наличие веществ, которые могут образоваться в результате реакции, может сдвигать равновесие реакции в одну или другую сторону. Некоторые вещества могут оказывать ингибирующее действие на реакцию, тогда как другие могут служить катализаторами и стимулировать ее протекание.
Таким образом, окружающая среда играет важную роль в реакции между основными оксидами. Температура, давление, присутствие катализаторов и химический состав окружающей среды могут существенно влиять на скорость и интенсивность реакции. Исследование этих факторов позволяет лучше понять процессы химической реакции и использовать эту информацию для разработки более эффективных искусственных процессов.
Примеры реакций между основными оксидами
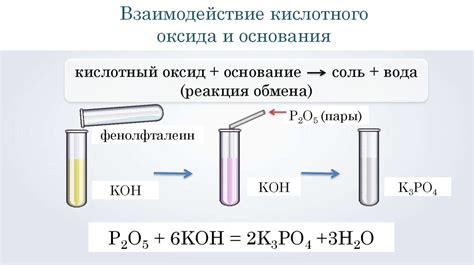
Реакция между основными оксидами происходит при контакте этих соединений с водой или кислотой. Они обладают свойствами щелочей и способны диссоциировать, выделяя гидроксидные ионы.
Ниже приведены некоторые примеры реакций между основными оксидами и водой:
- Реакция оксида натрия (Na2O) с водой:
- Na2O + H2O → 2NaOH
- K2O + H2O → 2KOH
- MgO + H2O → Mg(OH)2
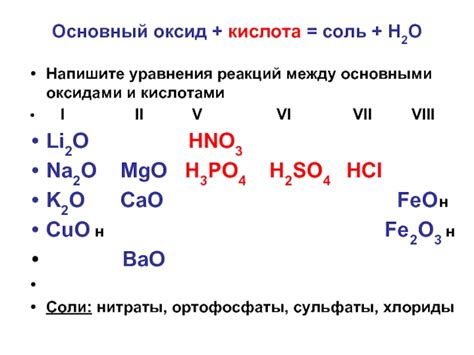
Реакции между основными оксидами и кислотами могут протекать с образованием соли и воды. Например:
- Реакция оксида кальция (CaO) с соляной кислотой (HCl):
- CaO + 2HCl → CaCl2 + H2O
- Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
- CuO + 2HNO3 → Cu(NO3)2 + H2O
Таким образом, реакция между основными оксидами может приводить к образованию гидроксидов, солей и воды в зависимости от веществ, участвующих в реакции.
Практическое применение реакции основных оксидов в различных областях
| Область применения | Описание |
|---|---|
| Производство стекла | Реакция между основными оксидами, такими как оксид кальция (CaO) и оксид натрия (Na2O), с кварцем приводит к образованию стекла. Эта реакция определяет свойства и структуру стекла, которое находит широкое использование в промышленности и быту. |
| Производство цемента | Реакция между оксидом кальция (CaO) и оксидом кремния (SiO2) играет ключевую роль в процессе производства цемента. При взаимодействии этих соединений образуется клинкер - основной компонент цемента. |
| Стабилизация почвы | Реакция между основными оксидами и кислотными соединениями в почве может использоваться для регулирования ее кислотности и улучшения ее качества. Например, оксид кальция (CaO) может использоваться для нейтрализации кислотности почвы и увеличения уровня pH. |
| Очистка воды | Реакция основных оксидов с загрязнителями в воде может быть использована для ее очистки и улучшения качества. Например, оксид железа (Fe2O3) может использоваться для удаления из воды различных загрязнений, включая органические вещества и тяжелые металлы. |
| Производство удобрений | Реакция между основными оксидами и кислотами может использоваться для производства удобрений. Например, оксид аммония (NH3) может реагировать с оксидом фосфора (P2O5), что приводит к образованию аммонийной фосфатной соли – важного компонента удобрений. |
Это лишь несколько примеров практического применения реакции между основными оксидами. Этот процесс имеет широкий спектр применения в различных областях нашей жизни, от промышленности до сельского хозяйства.