Оксид лития - это неорганическое вещество, представляющее собой соединение Лития (Li) и Кислорода (O). Этот химический соединитель встречается в природе в виде минерала с именем лития гидроксид (LiOH) и широко используется в промышленности и научных исследованиях. Одним из интересных аспектов оксида лития является его реакция с водой.
Когда оксид лития взаимодействует с водой, происходит химическая реакция, которая приводит к образованию гидроксида лития и выделению тепла. Это реакция эндотермического типа, то есть процесс поглощает тепло из окружающей среды. При взаимодействии с водой, молекулы оксида лития распадаются на ионы лития (Li+) и ионы кислорода (O-). В свою очередь, ионы лития соединяются с молекулами воды (H2O), образуя гидроксид лития и выделяя тепло.
Гидроксид лития (LiOH) является щелочным раствором, обладает амфотерными свойствами и хорошо растворяется в воде. Это вещество используется в различных отраслях промышленности, в том числе в производстве литий-ионных аккумуляторов, стекол и керамики, а также в фармацевтической и косметической промышленности.
Реакция оксида лития
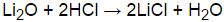
Особенностью реакции оксида лития с водой является образование щелочного гидроксида лития (LiOH) и выделение водорода (H2). Реакция протекает по следующей схеме:
| Li2O | + | 2H2O | = | 2LiOH | + | H2 |
|---|
Таким образом, реакция оксида лития с водой идет не только с образованием продуктов, но и с выделением газообразного вещества – водорода. Гидроксид лития, образующийся в результате реакции, обладает алкалинной реакцией и широко используется в качестве щелочного вещества.
Оксид лития также используется в процессе синтеза различных соединений и материалов, а также как компонент в электролитах для литий-ионных аккумуляторных батарей. Благодаря своим химическим свойствам, он находит применение в разных областях, включая электронику, металлургию и фармацевтику.
Свойства оксида лития

Ниже представлена таблица свойств оксида лития:
| Свойство | Значение |
|---|---|
| Химическая формула | Li2O |
| Молярная масса | 29,88 г/моль |
| Растворимость в воде | Растворяется с образованием щелочной среды |
| Температура плавления | 1436 °C |
| Температура кипения | Вещество не кипит, а разлагается |
| Тип связи | Ионная |
Оксид лития также обладает высокой теплопроводностью и электропроводностью. Он активно применяется в различных электронных устройствах и аккумуляторах. Также данный оксид используется в производстве стекол и керамики. Он может реагировать с водой, образуя щелочную реакцию и выделяя значительное количество тепла.
Взаимодействие с водой

Взаимодействие оксида лития с водой происходит очень активно и с выделением большого количества тепла. При добавлении небольшого количества воды к оксиду лития происходит резкое возгорание. Данный процесс сопровождается плавящимися и шипящими звуками.
Результатом данной реакции является образование гидроксида лития (LiOH), который является основанием. Он образуется в виде белого кристаллического вещества.
Взаимодействие оксида лития с водой часто используется в химических лабораториях для получения гидроксида лития и исследования свойств данного соединения.
Процесс реакции

| Реакция | Уравнение |
|---|---|
| Реакция оксида лития с водой | Li2O + H2O → 2LiOH |
При этой реакции образуется гидроксид лития (LiOH), который является щелочным соединением. Образовавшийся гидроксид лития растворяется в воде и образует литиевые и гидроксидные ионы (Li+ и OH-), которые придают раствору щелочные свойства.
Реакция оксида лития с водой протекает очень быстро и с выделением тепла. При этом молекулы воды разлагаются на водород и кислород, которые также выделяются в виде газовой смеси. Оксид лития, воздействуя на воду, исчезает, полностью превращаясь в гидроксид лития.
Особенности оксида лития при взаимодействии с водой

Оксид лития (Li2O) представляет собой неорганическое соединение, которое активно взаимодействует с водой. Это вещество имеет ряд уникальных особенностей, которые стоит учесть при его использовании или изучении.
Взаимодействие оксида лития с водой происходит с выделением значительного количества тепла. Данная реакция является экзотермической и может возникать при обычных условиях окружающей среды. Поэтому при проведении экспериментов или применении оксида лития необходимо соблюдать меры предосторожности, чтобы избежать возгорания или получения ожогов.
Во время реакции оксид лития с водой образуются три основных продукта: литиевый гидроксид (LiOH), перекись лития (Li2O2) и водород (H2). Литиевый гидроксид - это щелочное соединение, имеющее высокую растворимость в воде. Оксид лития также может взаимодействовать с водой в многоступенчатой реакции, в результате которой образуются различные гидроксиды лития.
Оксид лития обладает высокой активностью и химической реакционностью, что делает его полезным в различных областях, включая электрохимию и производство аккумуляторов. Это вещество также используется в фармацевтической и стекольной промышленности.
Оксид лития может вызывать раздражение при контакте с кожей, поэтому при работе с ним необходимо использовать перчатки и защитные очки. В случае попадания оксида лития на кожу или в глаза, необходимо немедленно промыть их водой и обратиться за медицинской помощью.
Поэтому при работе с оксидом лития важно соблюдать правила безопасности и проявлять осторожность. Знание особенностей взаимодействия оксида лития с водой позволяет использовать его эффективно и безопасно в различных сферах научных и промышленных исследований.
Химический состав получаемых продуктов

При реакции оксида лития с водой образуются следующие вещества:
Литийгидроксид (LiOH). Это щелочное вещество, обладающее сильной щелочной реакцией. Литийгидроксид используется в производстве сапунов, масел и щелочных аккумуляторов.
Водород (H2). При реакции оксида лития с водой образуется водородный газ, который является легким и воспламеняется при взаимодействии с кислородом. Водород используется в различных отраслях промышленности, включая производство аммиака и металлургические процессы.
Литийоксид (Li2O). Это нестабильное оксидное соединение, образующееся при реакции оксида лития с водой. Литийоксид обладает высокой реакционной способностью и широко применяется в химической промышленности.
В результате реакции оксида лития с водой образуются значимые продукты, которые находят широкое применение в различных областях промышленности.
Оксид водорода

Оксид водорода обладает рядом уникальных свойств, которые делают его незаменимым во многих химических и биологических процессах. Он является важным растворителем, способствующим разделению различных веществ на ионы и молекулы. Также он обладает высокой теплоемкостью и теплопроводностью, что делает его эффективным охладителем.
Вода является ключевым компонентом во многих биологических системах. Она участвует в реакциях гидролиза, химической реакции, при которой молекула воды расщепляется на ионы. Это позволяет организму получать энергию и осуществлять обмен веществ.
Оксид водорода также обладает уникальными свойствами, которые делают его ценным реагентом в химических процессах. Он может быть использован в качестве окислителя или восстановителя в различных реакциях. Один из наиболее известных примеров - взаимодействие оксида водорода с медным катодом в гальваническом элементе, что приводит к образованию электрического тока.
Оксид водорода также является одним из основных компонентов атмосферы Земли. Значительная часть воды находится в виде пара, который образуется при испарении жидкой воды. Вода в атмосфере выполняет ряд важных функций, в том числе участвует в процессах образования облаков и осадков и регулирует климатические процессы.
Гидроксид лития
Основные свойства гидроксида лития:
- Щелочной растворитель: Гидроксид лития является щелочным растворителем, что означает, что он растворяется в воде, образуя щелочную среду.
- Высокая щелочность: Гидроксид лития обладает высокой щелочностью и может вызвать коррозию, потому требуется аккуратное обращение с ним.
- Связь с водой: Гидроксид лития образует гидратированную форму в присутствии воды, что может повлиять на его свойства и реакционную способность.
- Высокая температура плавления: Гидроксид лития имеет высокую температуру плавления, что делает его полезным в некоторых высокотемпературных приложениях.
- Применение в промышленности: Гидроксид лития используется в производстве литиевых батарей, в производстве стекла и керамики, а также в литейной промышленности.
Гидроксид лития обладает некоторыми особенностями и свойствами, которые делают его полезным в различных отраслях промышленности. Его щелочные свойства и способность образовывать гидраты делают его важным компонентом в различных химических процессах и производстве материалов. Однако, из-за его высокой щелочности, необходимо соблюдать меры предосторожности при работе с ним.