Окисление и восстановление – два основных процесса, которые происходят в химических реакциях. Они играют важную роль во многих сферах нашей жизни, начиная от обычной окружающей среды и заканчивая биохимическими процессами в организме человека.
Оксидация (окисление) – это процесс, в ходе которого вещество теряет электроны. Окисление происходит, когда один вещественный компонент, называемый окислителем, переходит с высоким содержанием электронов в низкое. Это обуславливает возникновение химических изменений и образование новых соединений. Примером окисления может служить ржавчина на металлической поверхности, когда металл соединяется с кислородом воздуха, образуя оксид металла.
Восстановление (восстановление) – это процесс, противоположный окислению. В ходе восстановления вещество приобретает электроны. Восстановление происходит, когда вещество, называемое восстановителем, переходит с низким содержанием электронов в высокое. Это также приводит к химическим изменениям и образованию новых соединений. Примером восстановления является реакция горения, когда органические вещества, такие как древесина или уголь, сгорают в присутствии кислорода, выделяя углекислый газ и воду.
Когда происходит окисление вещества?
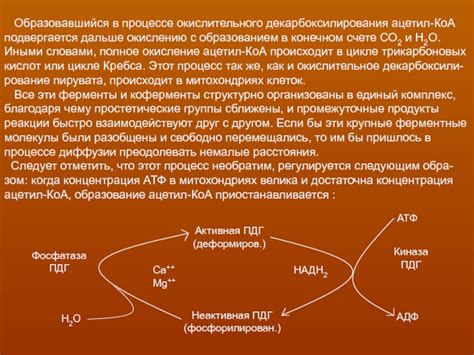
Окисление вещества происходит, когда оно теряет электроны или повышает свою электроотрицательность. Это явление может происходить при взаимодействии с кислородом или другими окислителями. В результате окисления, вещество может изменить свою структуру или свойства.
Окисление может происходить во многих химических реакциях. Один из наиболее распространенных примеров окисления - горение. В процессе горения, вещества окисляются под воздействием кислорода, при этом выделяется энергия и образуются новые вещества.
Окисление также может происходить в реакциях с растворителями или при взаимодействии с другими веществами. Важно отметить, что окисление всегда сопровождается процессом восстановления, когда другое вещество получает электроны или снижает свою электроотрицательность.
Окисление и восстановление веществ являются важными процессами в химии и имеют широкое применение в промышленности, аналитической химии и других областях науки и техники.
Важно понимать, что окисление и восстановление - взаимосвязанные процессы, их осуществление одновременно или последовательно играет важную роль во многих химических реакциях и процессах в природе.
Что такое окисление?
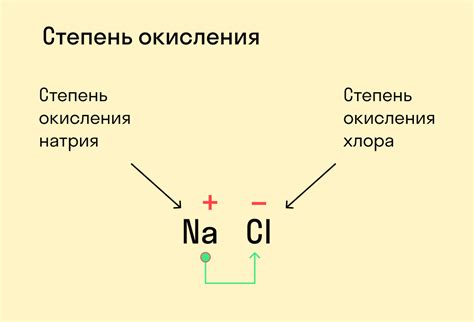
Окисление - одна из двух сторон реакции окисления-восстановления, где другой компонент называется восстановителем. Во время окисления окисляющее вещество получает электроны от восстановителя и, таким образом, восстанавливается.
Окисление происходит, когда вещество контактирует с веществом с более высоким потенциалом окисления. Например, кислород является сильным окислителем, поэтому многие окисления происходят в присутствии кислорода.
Окисление имеет большое значение в нашей повседневной жизни. Например, окисление металла может вызвать коррозию, поэтому мы защищаем металлические предметы от окисления. Окисление также играет важную роль в процессах топливного сжигания, где происходит окисление топлива.
Таким образом, окисление - важный процесс в химии, который приводит к изменению состояния вещества и может иметь значительные последствия в различных сферах нашей жизни.
Когда происходит восстановление вещества?
Восстановление может происходить в химических реакциях, где одно вещество окисляется, а другое восстанавливается. Например, в реакциях с электролитическим восстановлением, где происходит электролиз, или в реакциях, связанных с передачей электрона от одного вещества к другому.
Также восстановление может происходить в биологических системах. Например, процессы восстановления происходят внутри клеток организмов при дыхании, где молекулы глюкозы окисляются, а молекулы кислорода восстанавливаются. Этот процесс обеспечивает клеткам энергией для выполнения различных функций.
Восстановление также может происходить в экологических системах. Например, восстановление может происходить в процессе очистки воды, где происходит удаление загрязняющих веществ из воды путем их окисления, а затем восстановления.
| Компонент | Вещества, восстанавливающие его |
| Кислород | Восстановительные вещества (например, уголь, водород) |
| Металлы | Неметаллы (например, хлор, бром) |
| Оксиды | Восстановительные вещества (например, металлы, сероводород) |
Восстановление вещества является важным процессом во многих областях науки и техники, таких как химия, биология, экология и электротехника. Понимание этого процесса позволяет улучшить и оптимизировать различные процессы и реакции.
Что такое восстановление?

Основным признаком восстановления является увеличение валентности элемента или уменьшение его электроотрицательности. В процессе восстановления вещество, которое действует в качестве восстановителя, отдает электроны, тем самым окисляясь. Вещество, которое проходит восстановление, называется окисляемым веществом.
Восстановление может происходить как в анаэробных условиях (в отсутствие кислорода), так и в аэробных условиях (при наличии кислорода). Процессы восстановления играют важную роль не только в химии, но и в биологии, электрохимии и других областях науки.
Примеры восстановительных реакций: образование воды из водорода и кислорода, превращение железа из оксида в металлическую форму, окисление глюкозы в организме для получения энергии и многие другие.
Знание процессов восстановления позволяет управлять химическими реакциями, разрабатывать новые материалы и применять их в различных отраслях промышленности.