Периодический закон Менделеева – основополагающий закон химии, который описывает и систематизирует упорядоченный ряд химических элементов. Созданный великим русским химиком Дмитрием Ивановичем Менделеевым в XIX веке, закон стал неотъемлемой частью науки и развития химии. С его помощью удалось установить закономерности в поведении элементов, предсказать свойства новых элементов и создать систему классификации, которая до сих пор является основой для изучения химических элементов.
Основой периодического закона Менделеева является система расположения элементов в периодической таблице. Элементы в таблице разделены на периоды, которые соответствуют энергетическим уровням электронных оболочек атомов. Каждый период начинается с атома газообразного водорода и заканчивается инертным газом. Внутри одного периода элементы упорядочены по возрастанию атомного номера, что соответствует увеличению числа протонов в атоме.
Одним из принципов периодического закона Менделеева является группировка элементов по их свойствам и химической реактивности. Вертикальные столбцы в таблице называются группами и группируют элементы с аналогичными свойствами. Каждая группа содержит элементы с одинаковым числом электронов на внешней энергетической оболочке, что определяет их химические свойства и реактивность. Такое расположение элементов позволяет прогнозировать их свойства и химические реакции, исходя из свойств соседних элементов в таблице.
Основные принципы периодического закона Менделеева
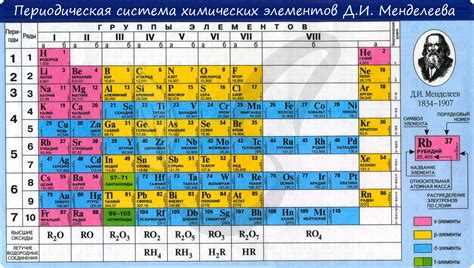
Основные принципы периодического закона Менделеева включают:
| 1. Порядковый номер | 2. Атомная масса | 3. Химические свойства |
|---|---|---|
| Каждый химический элемент имеет свой уникальный порядковый номер, который указывает на его положение в периодической системе. | Атомная масса элемента также играет важную роль в периодическом законе. Она определяется суммой протонов и нейтронов в ядре атома. | Химические свойства элементов имеют закономерное изменение при движении по периоду и группе. Это позволяет выделить различные классы элементов с похожими свойствами. |
Периодический закон Менделеева стал важным инструментом для предсказания свойств недостающих элементов, а также для последующего открытия их в природе. Он является основой для изучения химии и обладает большим практическим применением в различных областях науки и технологий.
Атомы и их строение
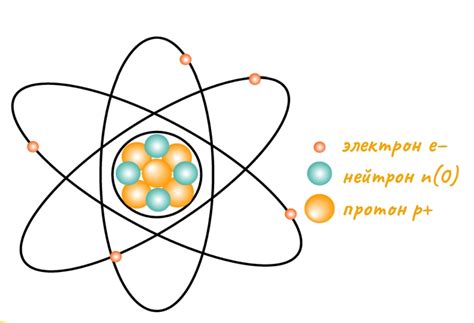
Протоны имеют положительный электрический заряд, нейтроны не имеют заряда, а электроны имеют отрицательный заряд. Протоны и нейтроны находятся в центре атома, который называется ядром. Электроны движутся вокруг ядра по определенным орбитам.
Количество протонов в атоме определяет его атомный номер, который также является порядковым номером элемента в периодической таблице. Нейтроны и протоны имеют примерно одинаковую массу, но масса электронов намного меньше.
Атомы элементов имеют разное количество протонов, но нейтроны и электроны в атомах одного элемента обычно имеют одинаковое количество.
Строение атомов и их взаимодействие определяют свойства элементов и их способность образовывать соединения.
Периоды и группы таблицы Менделеева
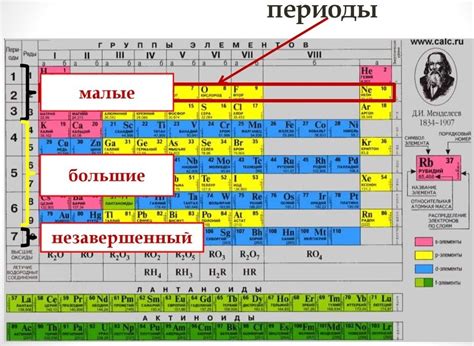
Периоды - это горизонтальные строки таблицы, которых всего семь. Каждый период представляет собой новый энергетический уровень, на котором находятся электроны атомов. Все элементы в одном периоде имеют одинаковое количество электронных оболочек и добавляют по одному электрону на каждый новый период.
Группы - это вертикальные столбцы таблицы. Их всего восемнадцать. Группы объединяют элементы схожих свойств и химической активности. Например, элементы в группе 1, или щелочные металлы, обладают общей особенностью - легкостью реакции с водой, при этом они имеют одно электрон во внешней электронной оболочке. А элементы группы 18, или инертные газы, практически не образуют химических соединений, так как их внешние электронные оболочки полностью заполнены.
Таким образом, периоды и группы таблицы Менделеева помогают классифицировать и упорядочить химические элементы в соответствии с их физическими и химическими свойствами. Они дают нам информацию о структуре атома и его электронной конфигурации, а также об их химической активности и реакционной способности.
| Группа | Название | Примеры элементов |
|---|---|---|
| 1 | Щелочные металлы | Литий (Li), Натрий (Na), Калий (K) |
| 2 | Щёлочноземельные металлы | Магний (Mg), Кальций (Ca), Барий (Ba) |
| 17 | Галогены | Фтор (F), Хлор (Cl), Бром (Br) |
| 18 | Инертные газы | Неон (Ne), Аргон (Ar), Криптон (Kr) |
Химические свойства элементов
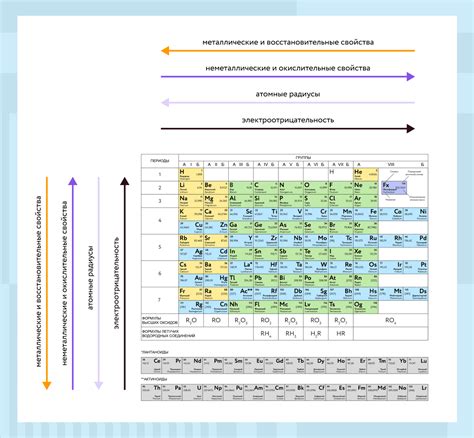
Химические свойства элементов определяют их поведение во взаимодействии с другими веществами. В периодической системе элементов свойства элементов часто группируются по вертикали в одну группу, что обусловлено сходством в их химическом поведении.
Одним из важнейших химических свойств элементов является их валентность - способность элемента образовывать связи с другими элементами. Валентность определяет количество электронов, которые может отдать или принять атом элемента.
Также химические свойства элементов определяются их реакционной способностью. Реакционная способность элементов зависит от их положения в периодической системе и от их электронной конфигурации. Некоторые элементы активно вступают в химические реакции, образуя новые вещества, в то время как другие элементы мало реакционны или совсем не реакционны.
Еще одним важным химическим свойством элементов является их охотность к электронам. Охотность к электронам определяет склонность элемента принимать или отдавать электроны при взаимодействии с другими элементами. Эта свойство имеет прямое отношение к электроотрицательности элемента.
| Группа | Период | Название | Химические свойства |
|---|---|---|---|
| 1 | 2 | Алкалии | Высокая реакционная способность, низкая охотность к электронам, образуют щелочные растворы |
| 2 | 3 | Земле-алкалии | Малая реакционная способность, низкая охотность к электронам, образуют нейтральные растворы |
| 17 | 2 | Галогены | Высокая реакционная способность, высокая охотность к электронам, образуют соли |
| 18 | 2 | Благородные газы | Низкая реакционная способность, очень высокая охотность к электронам |
Менделеев и его вклад в разработку периодического закона

В 1869 году Менделеев представил миру свой периодический закон, или таблицу химических элементов, которая стала основой современной системы классификации элементов. Эта таблица была организована по возрастающей атомной массе элементов и группировала их по свойствам и химическим реакциям. Однако Менделеев не только предложил удобную систему расположения элементов, но и предсказал существование новых элементов, которые были открыты позже.
Одной из главных особенностей периодического закона Менделеева является его принцип. Согласно этому принципу, химические элементы имеют сходные свойства, если их атомы имеют одинаковое количество электронов на внешнем энергетическом уровне. Это позволяет классифицировать элементы в группы и периоды и делает периодический закон Менделеева основой для химии и других наук, связанных с исследованием элементов и их соединений.
Вклад Менделеева в разработку периодического закона был столь значим, что его таблица стала всеобщим признанием и использовалась учеными и педагогами по всему миру. Благодаря его работе, ученые смогли установить связь между химическими свойствами элементов и их физическими характеристиками, что открыло двери для новых открытий и развития науки в области химии и физики.
Значение периодического закона Менделеева для науки и промышленности

В научной области периодический закон Менделеева является основой для изучения химических реакций, составления уравнений и проведения экспериментов. Благодаря этому закону ученые могут более точно предсказывать взаимодействие веществ и создавать новые соединения с определенными свойствами. Он также позволяет исследовать электронную структуру атомов и анализировать их поведение в различных условиях.
В промышленности периодический закон Менделеева имеет большое значение, поскольку позволяет создавать и улучшать различные материалы и продукты. Он помогает определить оптимальный состав сплавов и легированных материалов, а также оптимальные условия для синтеза и производства различных соединений. Знание периодического закона Менделеева также позволяет эффективнее использовать ресурсы и снижать затраты в процессе производства.
Благодаря периодическому закону Менделеева была создана таблица химических элементов, которая является основным инструментом для химиков и других специалистов в области естествознания. Она позволяет легко ориентироваться во множестве элементов и их свойств, облегчая научные исследования и разработку новых материалов и технологий.
Таким образом, периодический закон Менделеева играет важную роль в науке и промышленности, обеспечивая фундаментальные знания о свойствах и характеристиках элементов, их взаимодействиях и потенциальных применениях. Это является основой для развития современной химии и открывает широкие возможности для научных и технологических исследований, улучшения процессов производства и разработки инновационных материалов и препаратов.
Современные тенденции развития периодического закона

Периодический закон Менделеева, был впервые сформулирован в конце XIX века и на протяжении многих десятилетий являлся основой химической классификации элементов. Однако с развитием научных исследований и появлением новых технологий, возникла необходимость в дальнейшем развитии этого закона.
Современные тенденции в этой области связаны с более глубоким пониманием структуры атома и взаимодействия его электронных оболочек. Одной из важных модификаций периодического закона является включение в рассмотрение валентных электронов, которые играют решающую роль в химических реакциях и свойствах элементов.
Также, современные исследования показывают, что в некоторых случаях, периодический закон может иметь исключения. Например, существуют группы элементов, такие как лантаноиды и актиноиды, которые имеют сходные свойства, но размещены в разных рядах таблицы Менделеева.
Еще одним важным аспектом развития периодического закона является исследование и описание свойств и химических связей новых элементов. К таким элементам относится, например, искусственно созданный элемент с атомным номером 118 - оганессон. Исследования новых элементов позволяют расширить наши знания об атомной структуре и вносят свой вклад в современную химию.
Таким образом, современные тенденции развития периодического закона связаны с учетом более сложных факторов, таких как валентные электроны и взаимодействие атомных оболочек, а также с исследованием и описанием новых элементов. Понимание этих аспектов позволяет строить более точные модели взаимодействия элементов и предсказывать их свойства и реактивность.