Ковалентная неполярная связь – одно из важнейших понятий в химии, которое является основой для понимания многообразия химических реакций и веществ. Этот тип связи возникает между атомами, которые делят электроны с равным участием каждого атома. За счет совместного использования электронов, атомы образуют молекулы, что приводит к образованию структуры вещества и дает его уникальные свойства.
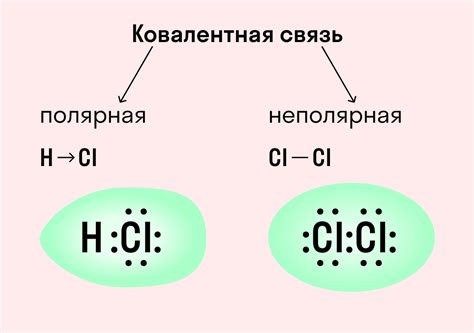
Слово "ковалентный" происходит от латинского "co-" (совместный) и "valere" (быть сильным), что отражает суть этого типа связи – совместное использование электронов. Неполярная связь означает отсутствие поляризации, т.е. разделения зарядов в молекуле. Это происходит из-за равного электроотрицательности атомов, участвующих в связи.
Одной из особенностей ковалентной неполярной связи является сильное притяжение и стабильность между атомами в молекуле. Электроны находятся в общем облаке вокруг ядер атомов, что создает кольцевую структуру. Размер и форма молекул определяются расстоянием и углами между связанными атомами.
Ковалентная неполярная связь: определение и значение

Особенностью ковалентной неполярной связи является равномерное разделение электронов между атомами. Это приводит к отсутствию электрической полярности в молекуле и отсутствию зарядов на атомах. Молекулы, образованные ковалентными неполярными связями, не взаимодействуют с полярными растворителями и не образуют ионных соединений.
Ковалентные неполярные связи играют важную роль в химии и биологии. Они образуют структурные единицы молекул органических соединений и являются основой молекулярной устойчивости днк-спиралей и белков. Кроме того, ковалентные неполярные связи представляют собой энергетически выгодные связи, которые могут участвовать в химических реакциях и обеспечивать стабильность молекул.
| Примеры молекул с ковалентной неполярной связью | Свойства |
|---|---|
| Молекула кислорода (O2) | Бесцветный газ, низкая растворимость в воде, электронегативность атомов кислорода примерно равна |
| Молекула азота (N2) | Бесцветный газ, низкая растворимость в воде, электронегативность атомов азота примерно равна |
| Молекула метана (CH4) | Бесцветный газ, низкая растворимость в воде, электронегативность атома углерода примерно равна электронегативности атомов водорода |
Различия между ковалентной и ионной связью
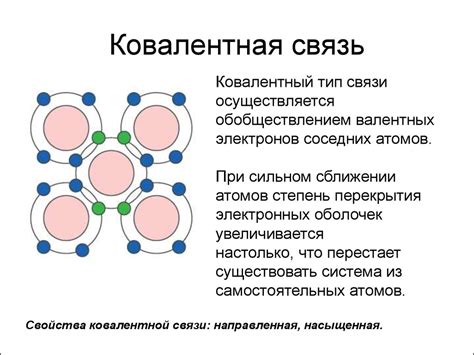
- Вид частиц: в ковалентной связи связанные атомы обменивают электроны, тогда как в ионной связи происходит передача электронов от одного атома к другому.
- Полярность: ковалентная связь может быть полярной или неполярной, в зависимости от разности электроотрицательности связанных атомов. В то время как ионная связь всегда является полярной.
- Связанные атомы: в ковалентной связи связанные атомы могут быть как однородными (т.е. одинаковыми по химическому составу), так и разнородными (разными по химическому составу), в то время как в ионной связи участвуют атомы разного химического состава.
- Сила связи: ионная связь обычно более сильная, чем ковалентная связь, из-за притяжения противоположных электрических зарядов в ионах. Ковалентная связь в общем случае слабее, так как электроны между связанными атомами распределяются более равномерно.
- Свойства соединений: соединения с ковалентной связью обычно могут быть газами, жидкостями или твердыми веществами при комнатной температуре и давлении, в то время как соединения с ионной связью обычно представлены твердыми кристаллическими веществами.
Важно отметить, что в реальности часто встречаются соединения, содержащие и ковалентные, и ионные связи в различных пропорциях. Такие соединения называются полярными смесями или половинками.
Принципы образования ковалентных неполярных связей
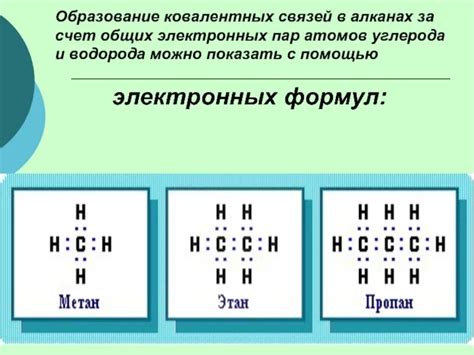
Ковалентная неполярная связь образуется между атомами, когда они обмениваются электронами и достигают электронной насыщенности. Принципы образования такой связи включают в себя следующие моменты:
- Атомы должны иметь способность образовывать ковалентные связи. Это возможно, если у атома есть несколько валентных электронов.
- Каждый атом должен иметь неспаренные электроны, которые могут участвовать в образовании связи.
- Атомы должны быть достаточно близкими друг к другу для возможности обмена электронами.
- Атомы должны иметь совместимые электроотрицательности. Ковалентная связь образуется, когда разница в электроотрицательности атомов не превышает некоторого значения.
При наличии всех вышеперечисленных условий, атомы будут образовывать ковалентные неполярные связи, в которых электроны равномерно распределены между атомами. Такие связи характеризуются отсутствием чистых зарядов и обычно возникают между атомами одного химического элемента или между атомами схожих электроотрицательностей.
Характеристики ковалентной неполярной связи

Основные характеристики ковалентной неполярной связи:
| Свойство | Описание |
|---|---|
| Сила связи | Ковалентная неполярная связь обладает высокой силой, так как электроны общей валентной оболочки образуют пару, общую для обоих атомов. |
| Длина связи | Длина ковалентной неполярной связи зависит от размеров атомов и равна среднему расстоянию между ядрами связанных атомов. |
| Направленность | Ковалентная неполярная связь является ненаправленной, так как электроны общей валентной оболочки равномерно распределены вокруг ядер атомов. |
| Энергия связи | Энергия ковалентной неполярной связи определяется величиной энергетического выделения при образовании связи между атомами. |
| Полярность | Ковалентная неполярная связь не имеет полярности, так как электроны равномерно распределены между атомами. |
Примеры веществ с ковалентной неполярной связью
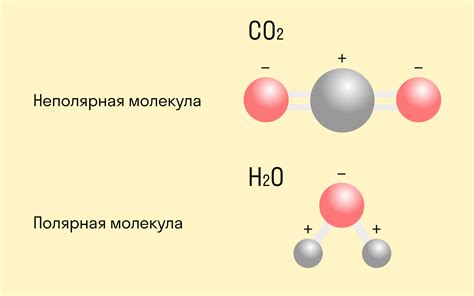
Ковалентная неполярная связь образуется между атомами, когда они делят электроны равномерно и не имеют разницы в электроотрицательности. Такие связи нерастворимы в воде, не проводят электрический ток и обычно обладают низкой температурой плавления и кипения. Вот некоторые примеры веществ, образующих ковалентные неполярные связи:
- Молекула кислорода (O2) - кислородные атомы образуют двойную ковалентную связь и обмениваются парами электронов.
- Молекула азота (N2) - азотные атомы также образуют двойную связь и обмениваются зарядами электронов.
- Молекула водорода (H2) - два атома водорода образуют одинарную ковалентную связь, разделяя пару электронов.
- Молекула метана (CH4) - углеродный атом образует одинарные ковалентные связи с четырьмя атомами водорода.
- Молекула этилена (C2H4) - два углеродных атома образуют две двойные ковалентные связи между собой.
Это лишь некоторые примеры веществ, обладающих ковалентной неполярной связью. Множество органических и неорганических соединений также образуют такие связи, что делает их основой для множества важных материалов и соединений в нашей жизни.
Важность ковалентной неполярной связи в химических реакциях
Важность ковалентной неполярной связи проявляется во множестве химических реакций. Одной из главных особенностей этой связи является ее стабильность и сильная прочность, что позволяет молекулам с аполярными связями образовывать кристаллические структуры с высокой температурной и химической стабильностью.
Ковалентная неполярная связь также играет важную роль в многих естественных процессах, таких как фотосинтез, дыхание и биохимические реакции в живых организмах. Важно отметить, что некоторые лекарственные препараты искусственно создают молекулы с аполярными связями для достижения требуемой стабильности и эффективности в организме.
Ковалентная неполярная связь также важна в промышленности, особенно в области производства пластмасс, которые широко используются в различных отраслях, таких как упаковка, автомобильная промышленность и электрическая инженерия. Молекулы с аполярными связями обладают прочностью и гибкостью, что делает их идеальными для создания легких, прочных и устойчивых материалов.
Практическое применение ковалентной неполярной связи

Ковалентная неполярная связь играет важную роль во множестве практических применений. Этот тип химической связи можно наблюдать во многих ежедневных предметах и процессах.
1. Органическая химия: Ковалентная неполярная связь широко используется в органической химии для образования сложных молекул. Молекулы углеводородов, таких как метан или этилен, содержат только ковалентные неполярные связи между атомами углерода и водорода.
2. Биология: В биологии, ковалентная неполярная связь имеет свое значение в формировании сложных молекул, таких как ДНК и белки. В ДНК, например, спиральная структура образуется благодаря ковалентным неполярным связям между нуклеотидами.
3. Фармацевтическая промышленность: Ковалентная неполярная связь играет важную роль в разработке и производстве фармацевтических препаратов. Множество лекарств, таких как аспирин или парацетамол, содержат ковалентные неполярные связи между атомами различных элементов.
4. Промышленность и технология: Ковалентная неполярная связь используется в множестве отраслей промышленности и технологии. Например, в производстве пластиков, ковалентные неполярные связи обеспечивают прочность и стабильность материала.
5. Синтез новых материалов: Исследования в области ковалентной неполярной связи помогают разработке новых материалов с уникальными свойствами. Это может применяться в различных отраслях, от электроники до аэрокосмической промышленности.
Все эти примеры показывают, насколько важна ковалентная неполярная связь в различных аспектах нашей жизни.