Белки – это одни из важнейших молекул в живой природе, выполняющие множество функций в организме. Они состоят из аминокислот и свернуты в сложную структуру, которая определяет их функциональность. Однако, структура белка может измениться из-за различных факторов, что может привести к нарушению их работы.
Процесс изменения структуры белка называется денатурацией. Существует несколько способов, которые могут привести к денатурации белка. Например, изменение pH среды, высокая температура, воздействие механической силы и химические реагенты. В результате денатурации белка происходит изменение его пространственной структуры, что приводит к потере его активности.
Одним из примеров изменения структуры белка является коагуляция крови. Когда нарушается целостность сосудов, плазма крови вытекает и контактирует с тканями. Белки в плазме крови, такие как фибриноген, подвергаются изменениям под действием фермента тромбина. В результате происходит изменение структуры фибриногена, его свертывание и образование сети фибрина, которая является основой тромба. Таким образом, изменение структуры белка играет решающую роль в процессе коагуляции крови.
Примеры изменения структуры белка: иллюстрации процессов
1. Денатурация: Воздействие физических или химических факторов, таких как температура, pH-среды или наличие растворителя, может привести к разрушению пространственной структуры белка. Это может произойти из-за разрыва водородных связей, гидрофобного взаимодействия или других сил, удерживающих белок в трехмерной структуре.
2. Фосфорилирование: Механизм, при котором фосфатная группа присоединяется к определенным аминокислотным остаткам в белке, называется фосфорилированием. Это может изменить электрический заряд белка и влиять на его пространственную структуру, что может привести к активации или инактивации белка.
3. Гликозилирование: Процесс, при котором сахарные молекулы присоединяются к белковым остаткам, называется гликозилированием. Это изменение может повлиять на взаимодействие белка с другими молекулами, его физические или химические свойства.
4. Протеолиз: Другим способом изменения структуры белка является протеолиз, при котором белок разрушается путем разрезания на меньшие фрагменты ферментами, такими как протеазы. Это может изменить функцию белка или его взаимодействие с другими молекулами.
Изменение структуры белка может иметь значительное влияние на его функцию и взаимодействие с другими молекулами. Понимание этих процессов является важным шагом в изучении белковой биологии и может помочь в разработке новых лекарственных препаратов и технологий.
Денатурация белка: внешние факторы и последствия

Вот некоторые из основных внешних факторов, способных вызвать денатурацию белка:
- Тепловое воздействие. Высокие температуры могут привести к нарушению сложной пространственной структуры белка. Это может привести к его неправильной работе или полной потере функции.
- Кислоты и щелочи. Взаимодействие белка с кислотами или щелочами может нарушить водородные связи в его структуре, что приведет к денатурации.
- Окислительное воздействие. Кислород и другие окислители могут повреждать белки, вызывая их денатурацию.
- Механическое действие. Интенсивное воздействие механической силы может нарушить структуру белка, что приведет к его денатурации.
Последствия денатурации белка могут проявляться различными способами:
- Потеря функций. При денатурации белок может потерять свою способность выполнять свою функцию в организме.
- Потеря активности ферментов. Белки-ферменты могут терять свою активность при денатурации, что может привести к нарушению метаболических процессов в организме.
- Образование агрегатов. Денатурированные белки могут образовывать агрегаты или осаждаться, что может привести к образованию белковых отложений.
- Аллергические реакции. Денатурированный белок может быть распознан иммунной системой организма как чужеродный и вызвать аллергическую реакцию.
Таким образом, денатурация белка является серьезной проблемой, которая может возникать под воздействием различных внешних факторов и иметь разнообразные последствия для организма.
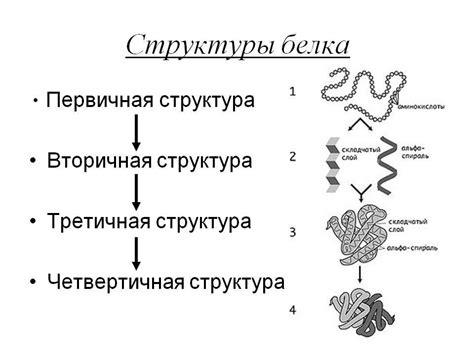
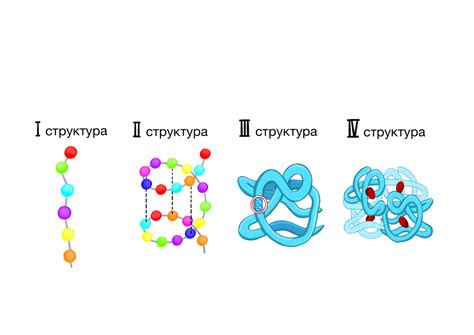
Первичная структура белка: последовательность аминокислот
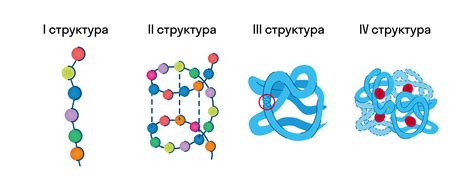
Первичная структура белка представляет собой последовательность аминокислот, связанных между собой пептидными связями. Точная последовательность аминокислот определяется генетической информацией, содержащейся в ДНК организма.
Аминокислоты, из которых состоят белки, могут быть различными по своим химическим свойствам, таким как заряд, гидрофобность или гидрофильность. Именно комбинация этих аминокислот определяет функциональные и структурные свойства белка.
Первичная структура белка является основным уровнем организации белковой молекулы. Она служит основой для последующих структурных изменений, таких как образование вторичной, третичной и кватернарной структур белка.
Изучение первичной структуры белка позволяет установить его генетическую информацию, а также предсказать его функцию и участие в биологических процессах организма.
Примеры методов определения первичной структуры белка:
- Метод Сангера,
- Масс-спектрометрия,
- Методы выравнивания последовательностей аминокислот.
Вторичная структура белка: α-спираль, β-листы и мотивы
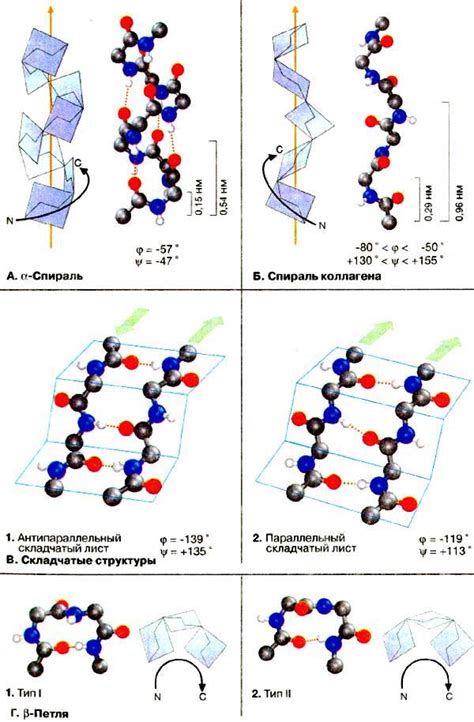
α-Спираль является наиболее устойчивой и распространенной формой вторичной структуры белка. Она образуется из одной или нескольких протяженных цепочек аминокислот, которые образуют спираль с правой витой структурой. Внутри α-спирали между аминокислотными остатками образуются водородные связи, которые поддерживают стабильность структуры. Эта структура особенно важна при формировании мембранных белков, которые могут проникать через клеточную мембрану.
β-Листы – это структура, в которой протяженные цепочки белка сворачиваются в виде листа, сформированного параллельными или антипараллельными стрендами. Аминокислотные остатки внутри β-листа также образуют водородные связи между собой, что придает структуре прочность и устойчивость. Эта структура обладает большей гибкостью и позволяет взаимодействовать с другими молекулами, что делает β-листы важными для функций белка, таких как связывание сигнальных молекул или других белков.
Вторичная структура белка также может образовывать мотивы – короткие последовательности аминокислот, которые обладают уникальной структурой и функцией. Мотивы часто участвуют в различных физиологических и биологических процессах, таких как связывание субстратов или взаимодействие с другими белками.
| Тип вторичной структуры | Описание |
|---|---|
| α-спираль | Пространственная структура, образованная протяженными цепочками аминокислот, образующими спираль с правой витой структурой. |
| β-лист | Структура, в которой протяженные цепочки белка сворачиваются в виде листа, образующего параллельные или антипараллельные стренды. |
| Мотивы | Короткие последовательности аминокислот, обладающие уникальной структурой и функцией. |
Третичная структура белка: сворачивание в пространстве
Процесс сворачивания третичной структуры белка может протекать различными путями в зависимости от внешних условий, таких как pH, температура или наличие других молекул. В результате сворачивания белок принимает определенную трехмерную конформацию, которая позволяет ему выполнять свою функцию.
Сворачивание белка происходит благодаря сложным физико-химическим взаимодействиям между аминокислотными остатками. Важную роль в этом процессе играют водородные связи, взаимодействия гидрофобных и гидрофильных остатков, ионообменные взаимодействия и другие силы, которые способны собрать белок в определенную форму.
Третичная структура белка является ключевым фактором, определяющим его функцию в клетке. Даже небольшие изменения в третичной структуре могут привести к нарушению функции белка и развитию патологических состояний. Поэтому изучение третичной структуры белков и процессов, связанных с ее формированием, является актуальной и важной задачей в молекулярной биологии.
Кватерническая структура белка: сложные многосубъединичные комплексы
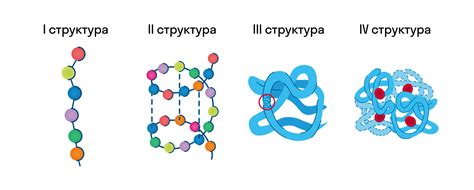
Кватерническая структура белка описывает взаимное размещение и взаимодействие субъединиц в составе многосубъединичного комплекса. Она определяет уникальную архитектуру и функциональность таких комплексов. Кватерническая структура может быть обусловлена различными факторами, включая взаимодействие гидрофобных участков, водородных связей и электростатических взаимодействий.
Знание кватернической структуры белка позволяет лучше понять его функции и взаимодействия с другими молекулами в клетке. Такие знания важны для разработки лекарственных препаратов, поскольку сложные многосубъединичные комплексы часто являются мишенями для лечения различных заболеваний.
Для иллюстрации кватернической структуры белка обычно используется таблица, в которой каждая субъединица представлена отдельной строкой. В каждой строке указывается название субъединицы, ее структура и взаимодействия с другими субъединицами. Таблица часто сопровождается диаграммами, позволяющими наглядно представить взаимное расположение субъединиц в многосубъединичном комплексе.
| Субъединица | Структура | Взаимодействие с другими субъединицами |
|---|---|---|
| Субъединица А | Альфа-спиралевидная структура | Гидрофобное взаимодействие с субъединицей В, образование активного центра |
| Субъединица В | Бета-листовидная структура | Гидрофобное взаимодействие с субъединицей А, связывание с молекулой С |
| Субъединица С | Глобулярная структура | Связывание с субъединицей В, участие в катализе реакции |
Таким образом, кватерническая структура белка играет важную роль в понимании его функциональности и взаимодействия с другими молекулами. Использование таблиц и диаграмм позволяет наглядно представить сложные многосубъединичные комплексы и их структуру.
Изменение структуры белка: мутация и ее влияние на функцию
Белки играют ключевую роль во множестве биологических процессов, выполняя разнообразные функции в организме. Их структура обеспечивает способность выполнять эти функции, поэтому даже незначительное изменение в структуре белка может привести к нарушению его функции.
Мутация - это изменение последовательности нуклеотидов в гене, что может привести к изменению аминокислотной последовательности белка. Такие изменения могут возникать вследствие ошибок во время дублирования ДНК, воздействия мутагенов или появления спонтанных изменений. В результате изменения в аминокислотной последовательности могут возникать новые, измененные белки.
Мутации могут иметь различные последствия для структуры и функции белка. Они могут привести к появлению новых функций, изменению активности уже существующей функции или полной потере функции. Некоторые мутации могут изменить только одну аминокислоту в последовательности, в то время как другие могут привести к крупным изменениям в структуре белка.
Даже небольшое изменение в структуре белка может существенно изменить его способность взаимодействовать с другими молекулами. Это может сказаться на функции белка и привести, например, к потере способности связываться с целевым белком или изменению скорости реакций. В результате изменения структуры белка могут возникать различные патологические состояния и заболевания.
Изучение изменений в структуре белков и их влияния на функцию играет важную роль в молекулярной биологии и медицине. Это помогает понять механизмы развития заболеваний и разработать новые лекарственные препараты, направленные на коррекцию изменений в структуре и функции белков.