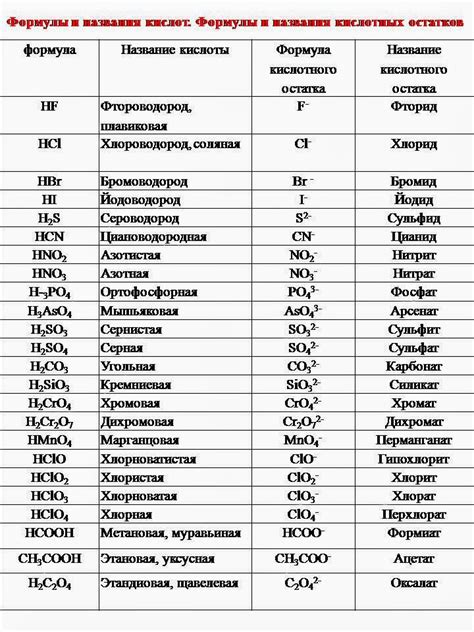
Соль и кислота – два вещества, играющих важную роль в химических процессах и обладающих различными свойствами. Соль – это химическое соединение, образованное ионами, которые связаны электростатическими силами. Кислоты же представляют собой сильные или слабые электролиты, способные давать положительные ионы в растворе.
Взаимодействие солей и кислот может происходить различными способами. Одним из таких способов является реакция нейтрализации, при которой соль и кислота взаимодействуют, образуя воду и соль. Такая реакция происходит при соединении протонов кислоты с отрицательными ионами соли. Например, реакция нейтрализации между солью хлорида натрия и кислотой соляной будет иметь следующий вид:
NaCl + HCl → H2O + NaCl
Еще одним важным типом реакций, связанных с взаимодействием солей и кислот, является гидролиз. Гидролиз – это реакция соли с водой, при которой происходит разложение ионов соли на ионы кислоты и щелочи. Например, реакция гидролиза соли ацетата натрия будет иметь следующий вид:
NaCH3COO + H2O → CH3COOH + NaOH
Таким образом, взаимодействие солей и кислот может приводить к образованию новых соединений, а также изменению их свойств. Изучение данных реакций имеет большое значение не только в химии, но и в биологии, медицине и других отраслях науки.
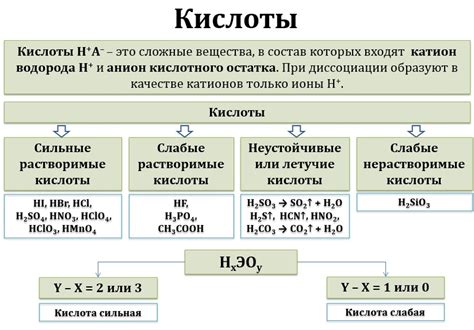
Свойства солей и кислот

Одно из основных свойств солей - их растворимость. Растворимость солей зависит от различных факторов, таких как температура и концентрация раствора. Некоторые соли очень хорошо растворяются в воде, в то время как другие имеют низкую растворимость.
Кислоты - это химические соединения, которые могут отдавать протоны (водородные ионы) в растворе. Одно из основных свойств кислот - их кислотность. Кислотность может быть измерена с помощью pH-метра. Кислоты обладают различными физическими и химическими свойствами, и они играют важную роль во многих химических реакциях и процессах.
Соли и кислоты могут образовывать различные химические соединения и взаимодействовать друг с другом. Например, при реакции соляной кислоты с гидроксидом натрия образуется соль - хлорид натрия и вода. Такие реакции называются нейтрализационными реакциями.
Особенности свойств солей и кислот являются важными для понимания различных химических процессов и реакций, а также для применения этих веществ в различных областях, таких как медицина, пищевая промышленность и производство материалов.
Химические реакции между солями и кислотами

Одной из самых распространенных реакций между солями и кислотами является нейтрализационная реакция. В результате этой реакции ион водорода из кислоты замещается положительно заряженным металлическим ионом из соли, образуя воду и соль. Например, реакция между соляной кислотой (HCl) и гидроксидом натрия (NaOH) приводит к образованию натрий хлорида (NaCl) и воды (H2O).
Кроме того, существует ряд других реакций между солями и кислотами, в результате которых образуются различные соли и вода. Например, реакция между серной кислотой (H2SO4) и гидроксидом калия (KOH) приводит к образованию калийсульфата (K2SO4) и воды (H2O).
Важно отметить, что химические реакции между солями и кислотами могут проходить только в определенных условиях. Например, для проведения нейтрализационной реакции необходимо поддерживать определенную температуру и pH-уровень реакционной среды. В противном случае, реакция может не произойти или протекать с низкой скоростью.
| Соль | Кислота | Реакция |
|---|---|---|
| Хлорид натрия (NaCl) | Соляная кислота (HCl) | NaCl + HCl → NaCl + H2O |
| Карбонат кальция (CaCO3) | Уксусная кислота (CH3COOH) | CaCO3 + 2 CH3COOH → Ca(CH3COO)2 + CO2 + H2O |
| Фосфат аммония ((NH4)3PO4) | Фосфорная кислота (H3PO4) | (NH4)3PO4 + 3 H3PO4 → 3 (NH4)2HPO4 |
Химические реакции между солями и кислотами имеют широкое применение в промышленности и лаборатории. Они используются для получения различных солей, которые затем могут быть использованы в производстве различных продуктов, включая удобрения, лекарства и пищевые добавки.
Физические проявления взаимодействия солей и кислот

Взаимодействие солей и кислот приводит к различным физическим проявлениям, которые могут быть наблюдаемыми и измеряемыми. Эти проявления включают изменение цвета раствора, выделение газовых пузырей, изменение pH, образование осадка или раствора и т.д.
Один из самых распространенных физических проявлений взаимодействия солей и кислот - изменение цвета раствора. Некоторые соли и кислоты обладают различными окрасками, и при их соединении может происходить окрашивание раствора в новый цвет. Это может быть использовано как индикатор реакции и помочь определить, произошло ли взаимодействие между солью и кислотой.
Выделение газовых пузырей также может быть наблюдаемым при взаимодействии солей и кислот. Некоторые соли, такие как карбонаты, реагируют с кислотами и выделяют углекислый газ. Это можно увидеть в виде пузырьков газа, появляющихся в растворе. Этот процесс называется газообразованием.
Изменение pH является еще одним физическим проявлением взаимодействия солей и кислот. Кислоты обладают низким pH, а соли могут иметь как нейтральный, так и щелочной pH. При взаимодействии с кислотой соль может изменить свой pH, становясь более кислым или щелочным. Изменение pH можно измерить с помощью pH-метра или индикаторной бумажки.
Образование осадка или раствора является еще одним физическим проявлением взаимодействия солей и кислот. Некоторые соли могут не растворяться полностью в воде и образовывать осадок или выпадать в осадок при взаимодействии с кислотой. Этот процесс называется осаждением. Наоборот, некоторые ранее образовавшиеся осадки могут растворяться при взаимодействии с кислотой, что называется растворением.
Таким образом, физические проявления взаимодействия солей и кислот включают изменение цвета раствора, выделение газовых пузырей, изменение pH и образование осадка или раствора. Эти проявления могут быть использованы для определения, произошло ли взаимодействие между солью и кислотой, и изучены как часть химических реакций и экспериментов.
Практическое применение реакций солей и кислот
Реакции солей и кислот находят широкое применение в различных областях человеческой деятельности. Ниже представлены некоторые примеры практического использования этих реакций.
1. Производство удобрений
Реакции солей и кислот используются в производстве удобрений, которые являются важным компонентом сельского хозяйства. Кислотные растворы применяются для нейтрализации солей, что позволяет получить удобрения с нужным pH-уровнем, необходимым для оптимального роста растений.
2. Производство пищевых добавок
Некоторые соли и кислоты используются в производстве пищевых добавок. К примеру, лимонная кислота, получаемая из цитрусовых фруктов, используется как консервант для продуктов питания и напитков. Некоторые соли, такие как хлорид натрия (поваренная соль) и глюконат кальция, используются для придания определенного вкуса и текстуры пищевым продуктам.
3. Очистка воды
Соли и кислоты применяются для очистки воды, используемой в различных целях, включая питьевую воду. Например, хлорид натрия (поваренная соль) используется в процессе осмотической очистки воды, при которой соль и другие загрязнители удаляются путем прохождения через полупроницаемую мембрану.
4. Кожевенное производство
Реакции солей и кислот играют важную роль в кожевенной промышленности. Кислоты используются для удаления остатков мягкой ткани с начального материала, придают коже гибкость и защищают от гниения. Соли используются в процессе выделки кожи для улучшения ее структуры и прочности.
5. Медицинская промышленность
Соли и кислоты также широко применяются в медицинской промышленности. Например, соляная кислота используется для производства различных лекарственных препаратов. Кислотные растворы используются для уколов и процедур, а соли являются ключевыми ингредиентами в составе многих лекарственных формул.
6. Производство взрывчатых веществ
Некоторые соли и кислоты используются в производстве взрывчатых веществ, таких как динамит и тротил. Эти вещества широко используются в горнодобывающей промышленности и для военных целей.
Вышеуказанные примеры лишь некоторые из областей, в которых применяются реакции солей и кислот. Разнообразие их использования подчеркивает важность понимания этих реакций и их значимость для различных отраслей нашей жизни.
Важность солей и кислот в ежедневной жизни
Соли и кислоты играют важную роль в нашей ежедневной жизни. Они присутствуют в пище, водах, бытовых средствах и многих других предметах.
Соли являются неотъемлемой частью нашей пищи. Они добавляют не только вкус, но и важные микроэлементы в наш организм. Некоторые из них не могут быть синтезированы организмом самостоятельно, и поэтому мы получаем их из пищи. Например, натрий и калий являются необходимыми для правильной работы сердечно-сосудистой системы и нервной системы. Кальций помогает строить здоровые кости и зубы. Магний участвует в процессах образования энергии и мышечных сокращений.
Кислоты также важны для нашего организма. Они помогают переваривать пищу и выполнять множество других функций. Желудочный сок, содержащий соляную кислоту, помогает расщеплять пищу в желудке. Витамин С, который является аскорбиновой кислотой, играет важную роль в иммунной системе и участвует в синтезе коллагена.
Кроме пищи, соли и кислоты также находят применение в других сферах. Например, соляные растворы используются для ухода за кожей и волосами, так как они могут быть антисептическими и очищающими. Кислоты, такие как уксусная кислота, находят применение в бытовых средствах для удаления накипи и известкового налета.
Таким образом, соли и кислоты являются неотъемлемой частью нашей жизни. Они не только обеспечивают разнообразие вкусов и запахов, но и важны для нашего здоровья и благополучия.