Растворы с определенной степенью устойчивости к изменению pH называются буферными растворами. Они играют важную роль в химическом анализе, биологии и многих других областях науки. Определить, является ли раствор буферным, может быть полезным для понимания его свойств и возможного применения.
В первую очередь следует узнать состав раствора. Буферными считаются растворы, у которых есть химические компоненты, способные принимать на себя либо отдавать протоны (H+). Обычно в буферных растворах присутствуют слабая кислотная и ее сопряженная слабая основа. Примерами таких систем могут служить уксусная кислота и ее соли, аммоний и хлорид аммония и так далее.
Другой способ определения буферности растворов – это измерение их pH. Если pH раствора практически не меняется при добавлении кислоты или щелочи, можно сказать, что это буферный раствор. Именно в этом состоит главное свойство буферного раствора – его способность поддерживать постоянное значение pH при внешних изменениях. Такое поведение раствора объясняется наличием слабых кислот и слабых основ, которые способны принимать на себя избыток или отдачу H+.
Определение буферного раствора: 6 признаков

1. Концентрация ионов водорода и гидроксида
Буферный раствор обладает определенной концентрацией ионов водорода (pH) и гидроксида (pOH). Он может иметь как кислую среду (низкий pH), так и щелочную среду (высокий pH), при этом его концентрация iонов будет поддерживаться стабильной.
2. Вещества-компоненты раствора
В буферном растворе присутствуют два компонента: слабая кислота или щелочь, и ее соляная форма (соответственно, слабая основа или кислота). Эти компоненты взаимодействуют между собой, образуя буферную систему, сохраняющую стабильность pH раствора.
3. Способность поддерживать стабильный pH
Буферный раствор способен поддерживать стабильный pH, несмотря на добавление кислот или щелочей. При добавлении маленького количества кислоты или щелочи в буферный раствор, его pH будет изменяться незначительно. Это связано с буферной системой, которая способна компенсировать изменение концентрации ионов водорода или гидроксида.
4. Изменение pH при добавлении кислот и щелочей
Если при изначальном pH буферного раствора добавить кислоту, pH будет немного изменяться, оставаясь близким к исходному значению. То же самое произойдет при добавлении щелочи – pH также останется стабильным.
5. Концентрация компонентов буферного раствора
Соотношение концентраций слабой кислоты/слабой основы и ее соляной формы является ключевым фактором, определяющим буферные свойства раствора. Идеальное соотношение составляет 1:1, но оно может немного варьироваться в зависимости от конкретной буферной системы.
6. Использование буферных растворов
Буферные растворы широко используются в лабораторных исследованиях, медицине и промышленности. Они применяются для поддержания постоянного pH в различных процессах и реакциях, где стабильная среда является критическим фактором.
Работа раствора с кислотами и щелочами

Растворы, которые способны устойчиво поддерживать почти постоянное значение pH при добавлении небольших количеств кислоты или щелочи, называются буферными. Буферные растворы широко используются в химии и биологии для поддержания оптимальных условий реакций и функционирования организмов.
Когда в буферный раствор добавляется кислота, ионы водорода из кислоты реагируют с основанием, присутствующим в растворе. Эта реакция называется нейтрализацией. Ионы водорода превращаются в молекулы воды, тогда как основание превращается в кислоту с более низким pH. Таким образом, буферный раствор нейтрализует добавленную кислоту и его pH остается почти неизменным.
Аналогично, когда в буферный раствор добавляется щелочь, ионы гидроксида из щелочи реагируют с кислотой, присутствующей в растворе. Эта реакция также называется нейтрализацией. Ионы гидроксида превращаются в молекулы воды, тогда как кислота превращается в основание с более высоким pH. Буферный раствор нейтрализует добавленную щелочь и его pH остается стабильным.
Работа раствора с кислотами и щелочами в буферном состоянии обеспечивает сохранение рН раствора и поддержание оптимальной среды для проведения различных реакций и процессов. Это особенно важно в биологических системах, где даже небольшие изменения pH могут сильно повлиять на активность ферментов и функционирование клеток.
Стабильность pH в определенном диапазоне
Стабильность pH достигается благодаря наличию буферных пар, которые состоят из слабой кислоты и ее соответствующей соли или слабой основы и ее соли. Когда кислота или основа добавляются к буферному раствору, буферные пары мгновенно реагируют, поглощая или отдавая H+ и OH- и поддерживая тем самым постоянное значение pH.
Важно отметить, что каждый буферный раствор имеет свой уникальный диапазон стабильности pH, который зависит от химических свойств используемой кислоты или основы. Например, буферный раствор уксусной кислоты имеет стабильность в pH диапазоне от 4,75 до 5,25.
Для определения, является ли раствор буферным, можно использовать метод добавления кислоты или основы и измерение изменения pH с помощью pH-метра. Если pH раствора остается стабильным в определенном диапазоне, то это указывает на наличие буферного действия.
| Буферный раствор | Диапазон стабильности pH |
|---|---|
| Фосфатный буфер | 7,2-7,4 |
| Триетаноламинный буфер | 7,8-8,8 |
| Соляно-натриевый буфер | 2,0-4,0 |
Следует помнить, что стабильность pH буферного раствора может быть нарушена при добавлении слишком большого количества кислоты или основы, что может превысить его буферную способность.
Устойчивость к изменению pH при добавлении кислоты или щелочи
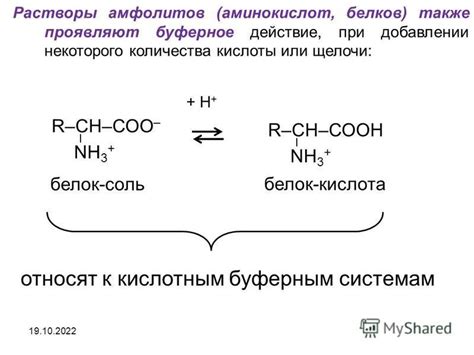
При добавлении кислоты или щелочи в буферный раствор происходит реакция между добавленными веществами и компонентами раствора. Буферные системы обладают особенностью реагировать с добавленными ионами, поддерживая эквивалентные концентрации и сохраняя стабильный уровень pH.
При добавлении кислоты в буферный раствор, активные компоненты раствора, называемые сопряженными кислотами, реагируют с ионами кислоты, образуя слабые кислоты. Эта реакция помогает увеличить концентрацию сопряженной кислоты и компенсировать изменение pH, сохраняя его относительно постоянным.
При добавлении щелочи в буферный раствор, сопряженные базы, которые являются активными компонентами раствора, реагируют с ионами гидроксида, образуя слабые основания. Эта реакция помогает увеличить концентрацию сопряженной базы и уравновесить изменение pH, обеспечивая стабильность раствора.
Устойчивость буферного раствора к изменению pH является результатом последовательной реакции между добавленными ионами и активными компонентами раствора. Чем выше концентрация сопряженных кислот или баз, тем более стабильным будет pH буферного раствора при добавлении кислоты или щелочи.
Важно отметить, что буферные растворы имеют определенный диапазон устойчивости pH, который зависит от концентрации активных компонентов и особенностей реакций, которые происходят при добавлении кислот или щелочей. При превышении этого диапазона pH раствора может измениться значительно, и он перестанет считаться буферным.
Присутствие слабой кислоты и ее солей

Слабая кислота и ее соли в буферном растворе действуют по принципу лей Шателье, основанного на принципах химического равновесия. Когда кислота распадается на ионы H+ и соответствующую конъюгированную базу, соли дают эту базу без H+.
Наличие слабой кислоты и ее солей в буферном растворе позволяет регулировать pH, устойчиво сохраняя его даже при добавлении кислоты или щелочи. Соли, содержащие катион, который не реагирует с водой, и анион, являющийся конъюгированной базой, уравновешивают изменение внешних и внутренних факторов.
Пример:
Раствор ацетата натрия (CH3COONa) и слабой кислоты уксусной (CH3COOH) является буферным раствором, так как находится в соотношении слабой кислоты и ее солей, и может поддерживать постоянный pH.
Соотношение концентрации солей слабых кислот и оснований
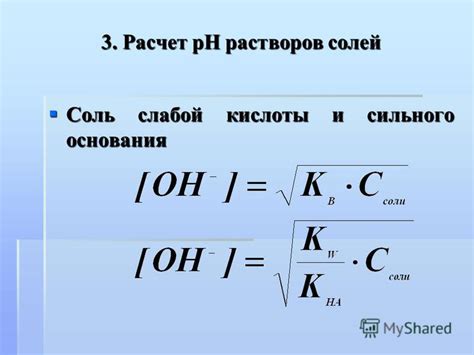
Такое соотношение между концентрациями солей слабых кислот и оснований обеспечивает устойчивость pH раствора в широком диапазоне. При добавлении кислоты или основания в буферный раствор, присутствие слабых кислот и оснований компенсируют изменение pH, поддерживая его практически неизменным.
Для определения, является ли раствор буферным, необходимо провести анализ концентраций солей слабых кислот и оснований. Если концентрации этих солей близки и соответствуют равным молекулярным концентрациям, это указывает на буферное свойство раствора.
Важно отметить, что для определения буферности раствора необходимо также учитывать пKa значения слабых кислот и оснований, а также состав буферной системы в целом. Процесс расчета и анализа концентраций солей слабых кислот и оснований является сложным и требует знания соответствующих теоретических и экспериментальных методов.
Поэтому, для определения буферности раствора и его соотношения концентрации солей слабых кислот и оснований, рекомендуется обратиться к специальной литературе или консультироваться с опытными химиками.
Физические свойства буферного раствора
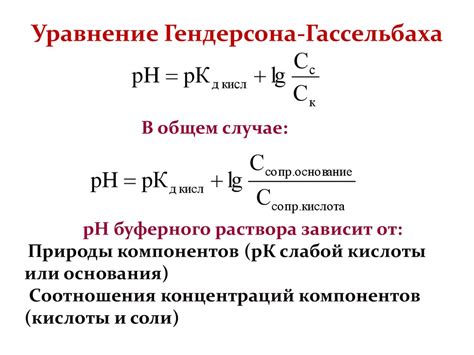
| 1. Стабильность pH | Буферный раствор должен иметь способность сохранять постоянное значение pH при малых изменениях в концентрации кислоты или щелочи. |
| 2. Разветвленность ионного равновесия | Буферный раствор должен содержать значительные количества слабой кислоты и ее сопряженного основания или слабой щелочи и ее сопряженной кислоты, чтобы обеспечить эффективное буферное действие. |
| 3. Отсутствие реакции на добавление малого количества кислоты или щелочи | Буферный раствор должен оставаться стабильным при добавлении небольшого количества кислоты или щелочи, чтобы избежать резких изменений pH. |
| 4. Электролитная активность | Буферный раствор должен обладать высокой электролитной активностью, чтобы минимизировать окислительно-восстановительные реакции и обеспечить стабильность pH. |
Зная физические свойства буферного раствора, можно определить, является ли данный раствор буферным и насколько эффективно он может поддерживать стабильное значение pH.