Электронная конфигурация атома является одним из основных понятий в химии, которое помогает описать распределение электронов в атоме. Это важная информация, которая позволяет предсказывать химические свойства элементов, их склонность к реакциям и образованию соединений.
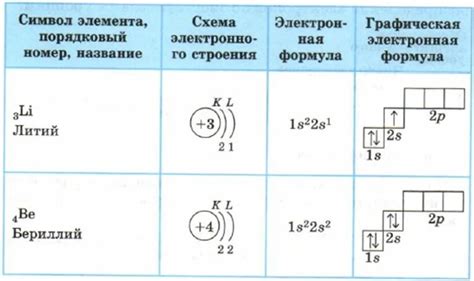
Как правило, электронная конфигурация атома записывается с использованием нотации "номер главной оболочки. буква п-электронов", где номер обозначает главную энергетическую оболочку, а буква показывает тип орбитали, на которой находятся электроны. Например, нотация 1s2 означает, что на первой главной оболочке находятся два электрона на s-орбитали.
Составление электронной конфигурации атома может быть сложной задачей, особенно для элементов с большим количеством электронов. Однако, с небольшой практикой и знанием основных правил, вы сможете легко составить электронную конфигурацию для любого атома. В этой статье мы рассмотрим несколько примеров и поделимся полезными советами, которые помогут вам в этом процессе.
Основные шаги составления электронной конфигурации атома:
- Определите атомный номер элемента:
- Разделите электронные оболочки:
- Запишите количество электронов в каждой оболочке:
- Заполните электроны по правилу Хунда:
Электронная конфигурация атома включает разделение электронов по электронным оболочкам. Электроны располагаются вокруг ядра в разных энергетических уровнях или оболочках. Внутренняя оболочка содержит меньшее количество электронов, а внешняя оболочка - большее количество.
Для каждой электронной оболочки атома, начиная с самой ближней к ядру, определите количество электронов. Количество электронов на каждой оболочке можно найти в таблице конфигурации электронов. Ответ записывается в виде числа или символа с верхним индексом (например, 2s2).
Последний шаг - распределение электронов в каждой оболочке по правилу Хунда. Правило Хунда гласит, что электроны заполняют энергетически низкие орбитали перед заполнением более высоких. Каждая орбиталь может вместить не более двух электронов, имеющих противоположный спин.
Понятие электронной конфигурации

В электронной конфигурации атома используются обозначения шеллов и подшеллов. Обозначение шелла состоит из числа (по порядку от нуля) и буквы, обозначающей тип подшелла: s, p, d, f. Например, первый шелл обозначается как 1s.
Подшеллы s, p, d, f обладают различными формами, а также максимальным числом электронов, которое они могут вместить:
- Подшелл s - сферическая форма, вмещает до 2 электронов.
- Подшелл p - форма двух стержней, вмещает до 6 электронов.
- Подшелл d - форма четырех стержней, вмещает до 10 электронов.
- Подшелл f - форма четырех сложных стержней, вмещает до 14 электронов.
Электроны заполняют подшеллы в порядке возрастания энергии. Правило заполнения называется принципом Ауфбау, который утверждает, что каждый следующий электрон занимает наиболее низший из доступных энергетических уровней.
Понимание электронной конфигурации атома позволяет предсказать его химические свойства и взаимодействия с другими атомами, а также выполнять расчеты и моделирование в различных областях науки и техники.
Правила заполнения электронных орбиталей

Для того чтобы составить электронную конфигурацию атома, необходимо знать правила заполнения электронных орбиталей. Важно учитывать, что электроны в атоме распределяются по орбиталям в определенном порядке, который регулируется следующими правилами:
- Принцип заполнения по возрастанию энергии. В соответствии с этим правилом, электроны заполняют орбитали в порядке возрастания их энергии. Сначала заполняются орбитали низшей энергии, а затем – орбитали более высокой энергии.
- Принцип исключения Паули. Согласно этому правилу, в каждой орбитали может находиться не более двух электронов, имеющих противоположные спины. Таким образом, каждая орбиталь может быть заполнена парами электронов, которые имеют противоположные направления магнитного момента.
- Правило Хунда. Это правило гласит, что при заполнении подуровней электроны предпочитают орбитали с одним электроном по отношению к орбиталям с парами электронов. Такое предпочтение связано с энергетическими особенностями электронов.
Методика записи электронной конфигурации

Электронная конфигурация атома записывается по определенным правилам исходя из расположения электронов в атоме.
- Сначала записываются электроны внутреннего (основного) электронного уровня, ближайшего к ядру. Они образуют ядро атома и не могут быть оторваны от него при химической реакции.
- Затем записываются электроны остальных электронных уровней, начиная с самого ближнего к ядру.
- На каждом электронном уровне электроны располагаются в энергетические подуровни, отмеченные буквами s, p, d, f. На подуровне s может находиться не более 2 электронов, на p – 6 электронов, на d – 10 электронов, на f – 14 электронов.
- Электроны на каждом подуровне распределяются по орбиталям – областям, в которых вероятность нахождения электрона максимальна. Каждая орбиталь может содержать не более 2 электронов с противоположной спиновой ориентацией.
На основе этих правил можно записать электронную конфигурацию атома. Например, для атома кислорода (O) электронная конфигурация будет выглядеть следующим образом: 1s2 2s2 2p4. Это означает, что на первом электронном уровне находится 2 электрона в орбитали s, на втором электронном уровне также находятся 2 электрона в орбитали s и 4 электрона в орбиталях p.
Знание методики записи электронной конфигурации атома помогает понять его строение и реакционную способность, а также прогнозировать его химическое поведение.
Примеры составления электронной конфигурации

Ниже представлены несколько примеров составления электронной конфигурации атомов:
Пример 1:
Атом гелия (He) имеет 2 электрона. Составим его электронную конфигурацию:
1s2
Пример 2:
Атом углерода (C) имеет 6 электронов. Составим его электронную конфигурацию:
1s2 2s2 2p2
Пример 3:
Атом кислорода (O) имеет 8 электронов. Составим его электронную конфигурацию:
1s2 2s2 2p4
Пример 4:
Атом железа (Fe) имеет 26 электронов. Составим его электронную конфигурацию:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Пример 5:
Атом аргон (Ar) имеет 18 электронов. Составим его электронную конфигурацию:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Обратите внимание, что для представления структуры атома используются энергетические уровни (оболочки) и подуровни (подоболочки), а также указывается количество находящихся на них электронов.