Давление газа – это одна из важнейших характеристик газообразных веществ, которая может влиять на их физические свойства и поведение. Знание давления газа при заданных условиях температуры и объема может быть полезно во многих практических ситуациях, от научных исследований до промышленного производства. Ответ на вопрос «Как найти давление газа при известной температуре и объеме?» может быть полезным как для студентов, изучающих физику и химию, так и для специалистов в различных отраслях науки и техники.
Для вычисления давления газа при известной температуре и объеме используется уравнение состояния идеального газа. Идеальный газ – это модель газообразных веществ, которая предполагает отсутствие межмолекулярных взаимодействий и совершенно эластичное столкновение молекул. В реальности идеальным газом можно считать ряд газов при низком давлении и высокой температуре, таких как воздух или гелий.
Формула, позволяющая найти давление газа при известной температуре и объеме, известна как уравнение идеального газа. Оно имеет следующий вид:
PV = nRT
где:
- P – давление газа
- V – объем газа
- n – количество вещества газа
- R – универсальная газовая постоянная
- T – температура газа (в абсолютной шкале, например, в Кельвинах)
Используя уравнение идеального газа, можно вычислить давление газа при заданных условиях температуры и объема. Например, при известных значениях объема газа (V), количества вещества (n) и температуры (T), можно определить его давление (P). Это уравнение также позволяет рассчитать одну из характеристик газа, если известны все остальные.
Как найти давление газа при известной температуре и объеме

Для вычисления давления газа при известной температуре и объеме можно использовать закон идеального газа. Этот закон формулируется следующим образом:
P = (n * R * T) / V,
где P - давление газа, n - количество вещества в молях, R - универсальная газовая постоянная, T - абсолютная температура газа, V - объем газа.
Для решения задачи необходимо знать значения трех из четырех переменных в уравнении. Для начала, необходимо перевести температуру в абсолютные единицы - Кельвины (K).
Допустим, у нас есть следующие данные: T = 273 К, V = 1 л и n = 1 моль. Универсальная газовая постоянная R равна 0,0821 л*атм/(моль*К).
Подставляем значения в формулу:
P = (1 * 0.0821 * 273) / 1 = 22.414 атм.
Поэтому при данной температуре, объеме и количестве вещества давление газа равно 22.414 атм.
Важно помнить, что величины должны быть в соответствующих единицах измерения. Например, температура должна быть в Кельвинах, а объем - в литрах.
Формула давления газа: основные принципы

Для определения давления газа при известной температуре и объеме используется закон Бойля-Мариотта, который гласит: давление газа обратно пропорционально его объему при постоянной температуре.
Математически закон Бойля-Мариотта можно записать следующей формулой:
P₁V₁ = P₂V₂
где P₁ и V₁ - начальное давление и объем газа, P₂ и V₂ - конечное давление и объем газа.
Таким образом, если известны начальное давление и объем газа, а также изменения объема, можно вычислить конечное давление газа.
Важно учитывать единицы измерения: давление газа обычно измеряется в паскалях (Па) или атмосферах (атм), а объем - в литрах (л) или кубических метрах (м³).
Например, если начальное давление газа равно 2 атмосферы, начальный объем - 5 литров, и объем газа увеличивается до 8 литров, можно использовать формулу Бойля-Мариотта для вычисления конечного давления:
P₁V₁ = P₂V₂
2 атм * 5 л = P₂ * 8 л
P₂ = (2 атм * 5 л) / 8 л = 1,25 атмосферы
Таким образом, конечное давление газа будет равно 1,25 атмосферы.
Закон Бойля-Мариотта и формула давления газа основаны на предположении, что температура газа остается постоянной. Если температура также изменяется, необходимо использовать другие законы, такие как закон Гей-Люссака или общее уравнение состояния газа.
Примеры расчета давления газа
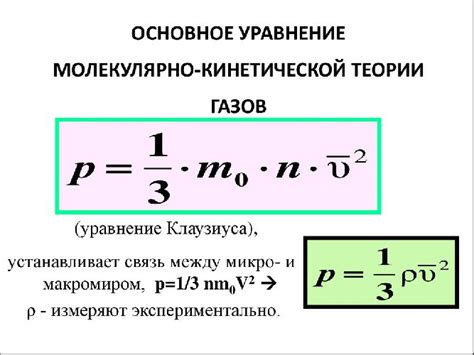
Рассмотрим несколько примеров, чтобы понять, как можно вычислить давление газа при известной температуре и объеме.
Пример 1:
Пусть у нас есть газ, занимающий объем 2 литра при температуре 25 градусов Цельсия. Найдем давление газа, если известно, что газ является идеальным.
Используем уравнение состояния идеального газа:
P * V = n * R * T
Где:
- P - давление газа
- V - объем газа
- n - количество вещества газа
- R - универсальная газовая постоянная
- T - температура газа в Кельвинах
Переведем температуру из градусов Цельсия в Кельвины, используя формулу:
T(K) = T(°C) + 273.15
В итоге получаем:
T(K) = 25 + 273.15 = 298.15 К
В уравнении состояния можно принять n = 1, так как мы имеем дело с одним молем газа. Также, зная, что универсальная газовая постоянная R = 0.0821 л * атм / (моль * К), мы можем рассчитать давление газа:
P = (n * R * T) / V = (1 * 0.0821 * 298.15) / 2 ≈ 12.19 атм
Таким образом, давление газа составляет приблизительно 12.19 атм.
Пример 2:
Пусть у нас есть баллон с газом, заполненный до объема 10 литров при температуре 20 градусов Цельсия. Найдем давление газа в баллоне, если газ является идеальным.
Используем уравнение состояния идеального газа:
P * V = n * R * T
Аналогично предыдущему примеру, переведем температуру в Кельвины:
T(K) = T(°C) + 273.15 = 20 + 273.15 = 293.15 К
Пусть в баллоне находится 2 моля газа. Тогда, используя уравнение состояния идеального газа, найдем давление:
P = (n * R * T) / V = (2 * 0.0821 * 293.15) / 10 ≈ 4.81 атм
Таким образом, давление газа в баллоне составляет примерно 4.81 атм.
Теперь вы сможете применить эти примеры и формулы для расчета давления газа при известной температуре и объеме ваших задачах и исследованиях.
Факторы, влияющие на давление газа

Температура: Повышение температуры газа приводит к увеличению его давления. Это связано с тем, что при повышении температуры молекулы газа обладают большей кинетической энергией и движутся более активно, что приводит к увеличению сил столкновений и, следовательно, давления.
Объем: Увеличение объема газа при постоянной температуре приводит к снижению его давления. Это объясняется тем, что с увеличением объема газа силы столкновений между молекулами газа становятся менее интенсивными и, следовательно, давление снижается.
Количество вещества: При постоянной температуре и объеме, увеличение количества вещества газа приводит к увеличению его давления. Это объясняется тем, что при увеличении количества газа, количество молекул, которые сталкиваются со стенками сосуда, также увеличивается, что приводит к повышению давления.
Вид газа: Различные газы при одинаковых условиях температуры, объема и количества вещества могут иметь разное давление. Это связано с различиями в массе и скорости движения молекул газов. Например, при одинаковых условиях давление водорода будет выше, чем давление азота.
Изучение влияния этих факторов на давление газа позволяет понять основные законы, которыми руководствуется поведение газов и применять их в различных областях науки и техники.