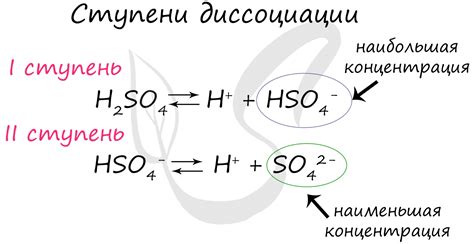
Диссоциация хлороводородной кислоты является одним из основных процессов, происходящих в растворах. Она представляет собой распад молекулы кислоты на ионы водорода (H+) и хлорида (Cl-). Данная реакция происходит в несколько ступеней, каждая из которых обладает своими особенностями и значимостью.
Первая ступень диссоциации хлороводородной кислоты представляет собой ее частичный распад на ионы H+ и Cl-. Хлоридные ионы (Cl-) образуют анионы, а ионы водорода (H+) - катионы. Эта ступень характеризуется высокой скоростью реакции и является наиболее значимой для понимания основных свойств кислотных растворов.
Вторая ступень диссоциации хлороводородной кислоты происходит при дальнейшем добавлении растворителя. На данной стадии происходит распад молекулы воды на ионы водорода (H+) и гидроксида (OH-). Образовавшиеся ионы H+ соединяются с ионами Cl- и образуют молекулы кислоты. Таким образом, концентрация ионов H+ уменьшается, а ионы OH- характеризуют раствор как щелочной.
Третья ступень диссоциации хлороводородной кислоты является более сложным процессом, включающим самые низкоэнергетические реакции. На данной стадии происходит распад молекулы воды на ионы водорода (H+) и оксида (O2-). При этом образующийся оксид переходит в основное состояние, образуя молекулы кислоты и молекулы кислотные оксиды. В результате третьей ступени диссоциации образуется сильное кислотное окислительное воздействие, что делает этот процесс весьма важным.
Что такое диссоциация хлороводородной кислоты?

Диссоциация происходит вода в присутствии хлороводородной кислоты и осуществляется по следующей реакции:
HCl → H+ + Cl-
В данной реакции молекула HCl расщепляется на катион водорода (H+) и анион хлорида (Cl-). Это происходит из-за передачи протона (H+) от молекулы HCl к молекуле воды.
Диссоциация хлороводородной кислоты является обратимым процессом, то есть она может протекать в обратную сторону при наличии достаточного числа ионов в растворе. Это объясняет свойство кислоты образовывать электролитические растворы, способные проводить электрический ток.
Диссоциация хлороводородной кислоты играет важную роль во многих химических процессах, включая кислотно-основные реакции и реакции образования солей. Кроме того, это свойство кислоты эксплуатируется во многих промышленных процессах, таких как производство хлорида натрия (NaCl) и других соединений хлора.
Процесс диссоциации хлороводородной кислоты
Процесс диссоциации происходит по следующим уравнениям:
HCl → H+ + Cl-
H+ + H2O → H3O+
В первом уравнении молекула хлороводородной кислоты разделяется на ионы водорода и хлорида. Ионы водорода могут существовать в воде в форме гидрона (H+) или ацидной гидрион (H3O+). Во втором уравнении ионы водорода реагируют с молекулами воды, образуя ионы гидрония (H3O+).
Диссоциация хлороводородной кислоты является обратимым процессом, что означает, что реакция может идти в обе стороны. Однако, в водных растворах типичное значение постоянной равновесия показывает, что процесс диссоциации идет в основном в направлении образования ионов водорода и ионов хлорида.
Диссоциация хлороводородной кислоты имеет значительное значение в химических и физических процессах. Ионы водорода играют важную роль в регулировании кислотно-щелочного баланса организма, а ионы хлорида участвуют в различных реакциях, таких как синтез органических соединений и очистка воды.
Кислотная диссоциация в зависимости от концентрации
Концентрация раствора влияет на скорость и степень диссоциации хлороводородной кислоты.
При низкой концентрации раствора хлороводородной кислоты, обычно менее 1 моль/л, диссоциация проходит почти полностью. Процент диссоциации кислоты возрастает с увеличением концентрации, что объясняется высокой активностью и силой взаимодействия молекул кислоты в разбавленном растворе.
Однако при повышении концентрации кислоты до насыщения, плотность молекулярных ионов может быть настолько высокой, что она препятствует дальнейшей диссоциации кислоты. В этом случае, процент диссоциации может стать меньше 100%.
Для определения зависимости процента диссоциации от концентрации, можно провести эксперименты с разными концентрациями раствора хлороводородной кислоты и измерить количество свободных ионов в растворе.
| Концентрация HCl, моль/л | Количество свободных H+ и Cl- ионов, моль/л | Процент диссоциации |
|---|---|---|
| 0.1 | 0.1 | 100% |
| 0.5 | 0.45 | 90% |
| 1 | 0.8 | 80% |
| 2 | 1.4 | 70% |
Роль диссоциации в промышленности и жизни
Одним из основных применений диссоциации хлороводородной кислоты является производство хлоридов, таких как хлорид натрия и хлорид кальция. Хлорид натрия широко используется в пищевой промышленности для консервирования и соления продуктов, а также в химической промышленности для производства пластмассы и каучука. Хлорид кальция применяется в строительстве, медицине, пищевой и фармацевтической промышленности.
Диссоциация хлороводородной кислоты также играет важную роль в очистке и обработке воды. Кислота используется для нейтрализации щелочи и устранения некоторых загрязнений, обеспечивая безопасность питьевой воды и воды, используемой в промышленных процессах.
Кроме того, диссоциация хлороводородной кислоты применяется в процессе гальванического покрытия, используемого для придания предметам защитного и декоративного покрытия. Кислота используется для очистки поверхности металла перед нанесением покрытия, а также для регулирования pH растворов и обеспечения оптимальных условий проведения электрохимического процесса.
Наконец, хлороводородная кислота имеет широкое применение в лабораторных условиях для регулирования pH растворов, проведения химических реакций и получения желаемых продуктов.
Таким образом, диссоциация хлороводородной кислоты играет значительную роль в промышленности и жизни, обеспечивая производство различных химических соединений, очистку воды, выполняя регулирование pH растворов и обеспечивая проведение различных химических процессов.